
【题目】“清肺排毒汤”来源于中医经典方剂组合,对新冠肺炎病毒感染的轻型、普通型的治疗具有良好的效果。其中的一味中药黄芩,其有效成分黄芩苷的结构简式如下图所示,下列有关黄芩苷的说法中正确的是( )
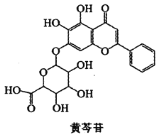
A.属于芳香族化合物,分子式为![]()
B.分子中苯环上的一氯代物有4种
C.可发生取代反应、加成反应,不能发生氧化反应
D.与足量![]() 发生加成反应后,官能团种类减少1种
发生加成反应后,官能团种类减少1种
科目:高中化学 来源: 题型:
【题目】有关下列四组实验描述不正确的是
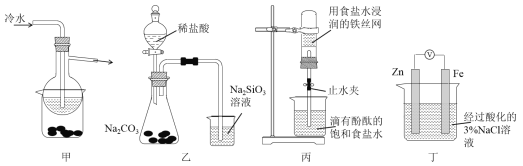
A. 加热甲装置中的烧杯可以分离SiO2和NH4Cl
B. 利用装置乙可证明非金属性强弱:Cl>C>Si
C. 打开丙中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中
D. 向丁中铁电极区滴入2滴铁氰化钾溶液,一段时间后,烧杯中不会有蓝色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是大气污染物之一,也是重要的化工原料。
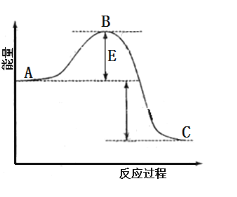
(1)某温度下,反应![]()
![]() 的能量变化如图。根据反应自发性判断,反应在______(填“高温”“低温”或“任何温度”)条件下可能有自发性,逆反应的活化能为______。
的能量变化如图。根据反应自发性判断,反应在______(填“高温”“低温”或“任何温度”)条件下可能有自发性,逆反应的活化能为______。
(2)将0.1 mol O2和0.2 mol SO2通入一容积可变的容器中进行反应:![]() 。测得SO2的平衡转化率随温度、压强的变化如图。
。测得SO2的平衡转化率随温度、压强的变化如图。
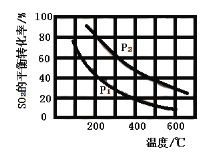
①![]() ______(填“>”“<”或“=”)
______(填“>”“<”或“=”)![]() 。
。
②若在300℃、压强为![]() 时,反应达到平衡,容器容积恰好为10 L,则此状态下反应的平衡常数K=____________。
时,反应达到平衡,容器容积恰好为10 L,则此状态下反应的平衡常数K=____________。
③反应![]() 在
在![]() 时刻达到平衡后,在
时刻达到平衡后,在![]() 时刻速率发生如图所示变化,此刻可能改变的反应条件可能是______(填标号)。
时刻速率发生如图所示变化,此刻可能改变的反应条件可能是______(填标号)。
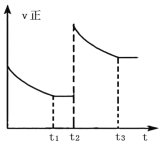
A.加压B.向体系中再通入一定量SO2
C.升高温度D.加催化剂
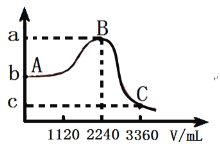
(3)常温下,向1L![]() 的水溶液中缓慢通入SO2气体(忽略溶液体积的变化),该溶液的pH与通入SO2气体的体积(标准状况)的关系如图,则
的水溶液中缓慢通入SO2气体(忽略溶液体积的变化),该溶液的pH与通入SO2气体的体积(标准状况)的关系如图,则![]() _____;
_____;![]() _____;
_____;![]() _____。已知:常温下,氢硫酸的
_____。已知:常温下,氢硫酸的![]() 、
、![]() ,亚硫酸的
,亚硫酸的![]() 、
、![]() ;
;![]() 。
。
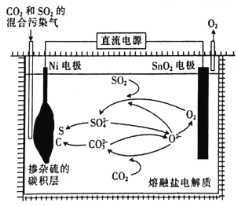
(4)用电解法处理CO2和SO2的混合污染气的原理如图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层,则与Ni电极相连的是电源的______(填“正极”或“负极”);阳极的电极反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁(FePO42H2O,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列实验制备磷酸铁.
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤.反应加热的目的是_____.
(2)向滤液中加入一定量H2O2氧化Fe2+,为使滤液中的Fe2+完全被H2O2氧化成Fe3+,下列实验条件控制正确的是_____(填字母编号).
A.加入适当过量的H2O2溶液 B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行 D.用氨水调节溶液pH=7
(3)往含有Fe3+的溶液中加入一定量的Na2HPO4溶液(溶液显碱性),搅拌、过滤、洗漆、干燥得到FePO42H2O.若反应得到的FePO42H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为_____.
(4)实验过程中用H2O2氧化Fe2+之前,为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式为:CrO![]() +6Fe2++14H+═2Cr3++6Fe3++7H2O
+6Fe2++14H+═2Cr3++6Fe3++7H2O
①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、_____和_____.
②若滴定x mL含Fe2+的滤液消耗a molL﹣1K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=_____ molL﹣1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】螺环烃是指分子中两个碳环共用一个碳原子的脂环烃。螺环烃A(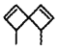 )是其中的一种。下列关于螺环烃A的说法中正确的是( )
)是其中的一种。下列关于螺环烃A的说法中正确的是( )
A.所有碳原子可能共平面
B.属于芳香烃的同分异构体数目有5种
C.常温时密度比水小,能溶于水及甲苯
D.与HBr以物质的量之比1:1加成生成的产物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“结构决定性质”是化学科学的重要理论。
(1)下列关于基态O原子结构的相关描述中错误的是________。
A.轨道表达式(电子排布图)为![]() B.有2个未成对电子
B.有2个未成对电子
C.电子占据最高能级的电子云轮廓图为哑铃(纺锤)形 D.价电子数为4
(2)Na的焰色反应为黄色,其原因是________。
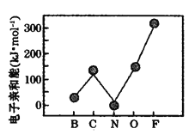
(3)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的电子亲和能E1变化趋势如图所示。氮元素的E1呈现异常的原因是________。
(4)K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___。
(5)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马日夫盐[Mn(H2PO4)2·H2O]主要用作磷化剂。以软锰矿(主要成分为MnO2及少量的FeO、Al2O3和SiO2)为原料制备马日夫盐的主要工艺流程如图:
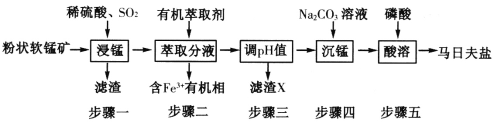
(1)按照无机物命名规律,马日夫盐[Mn(H2PO4)2·2H2O]的化学名称为______。在反应中,Mn2+若再失去一个电子比Fe2+再失去一个电子难,从原子结构解释其原因_______。
(2)“浸锰”过程中主要反应的离子方程式为_______。滤渣X主要成分为_________。检验“沉锰”已完成的实验操作及现象是_________。步骤五产生马日夫盐晶体的化学方程式为_________。
(3)Fe3+的萃取率与溶液的pH和接触时间之间的关系如图,据此分析,萃取的最佳条件为__________。

(4)马日夫盐作防锈磷化剂的原因是利用其较强的酸性以及在防锈处理过程中生成了具有保护作用的FeHPO4,马日夫盐显酸性的主要原因是__________(用相关化学用语回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硫酸亚铁晶体步骤如下:取洁净铁屑于烧杯中,加入一定量的稀硫酸,在50℃水浴中加热一段时间,趁热过滤,滤液转移至锥形瓶中,置于冰水浴中冷却,经一系列操作后获得产品。下列说法不正确的是( )
A.反应过程中烧杯底部一般保留少量铁屑以提高产品纯度
B.硫酸溶液浓度过低会降低晶体产率
C.水浴加热可以加快反应速率同时避免生成的![]() 发生爆炸
发生爆炸
D.与室温冷却相比,冰水浴冷却滤液可以更快获得更多更大的晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的同素异形体有很多,我国科学家成功地合成了通过理论计算预言的T-碳。回答下列问题:
(1)基态碳原子价层电子的轨道表达式(电子排布图)为________。
(2)石墨炔可由六炔基苯![]() 在铜片的催化作用下发生偶联反应得到。
在铜片的催化作用下发生偶联反应得到。
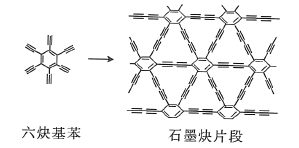
六炔基苯分子中的所有原子________(填“能”或“不能”)处于同一平面,六炔基苯属于________(填“极性”或“非极性”)分子,1个六炔基苯分子中含有![]() 键的数目为________。
键的数目为________。
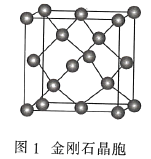
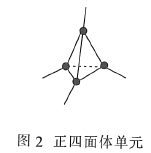
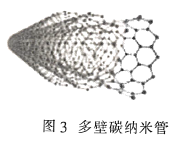
(3)金刚石(图1)中的每个碳原子用一个由4个碳原子组成的正四面体的结构单元(图2)取代,即得到T-碳。T-碳可通过皮秒激光照射悬浮在甲醇溶液中的多壁碳纳米管(图3)制得。多壁碳纳米管和T-碳中碳原子的杂化方式依次为________、________;溶剂甲醇中三种元素的电负性由大到小的顺序为________(用元素符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com