
【题目】碳的同素异形体有很多,我国科学家成功地合成了通过理论计算预言的T-碳。回答下列问题:
(1)基态碳原子价层电子的轨道表达式(电子排布图)为________。
(2)石墨炔可由六炔基苯![]() 在铜片的催化作用下发生偶联反应得到。
在铜片的催化作用下发生偶联反应得到。
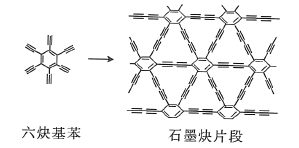
六炔基苯分子中的所有原子________(填“能”或“不能”)处于同一平面,六炔基苯属于________(填“极性”或“非极性”)分子,1个六炔基苯分子中含有![]() 键的数目为________。
键的数目为________。
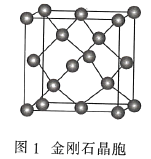
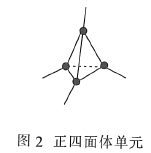
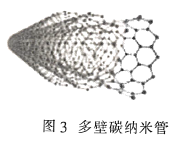
(3)金刚石(图1)中的每个碳原子用一个由4个碳原子组成的正四面体的结构单元(图2)取代,即得到T-碳。T-碳可通过皮秒激光照射悬浮在甲醇溶液中的多壁碳纳米管(图3)制得。多壁碳纳米管和T-碳中碳原子的杂化方式依次为________、________;溶剂甲醇中三种元素的电负性由大到小的顺序为________(用元素符号表示)。
【答案】 能 非极性 24
能 非极性 24
sp2 sp3 O>C>H
【解析】
(1)碳元素的原子序数为6,基态碳原子的价层电子排布为2s22p2;
(2)六炔基苯分子中苯环上的原子在同一平面,碳碳三键上原子在同一直线上;六炔基苯分子的结构对称;苯环中含有![]() 键,苯环中的碳原子与碳碳三键相连的碳原子形成
键,苯环中的碳原子与碳碳三键相连的碳原子形成![]() 键,碳碳三键中含有1个
键,碳碳三键中含有1个![]() 键,碳原子和氢原子形成
键,碳原子和氢原子形成![]() 键;
键;
(3)由题给示意图可知,多壁碳纳米管的结构类似于石墨晶体,T-碳的结构类似于甲烷;元素的非金属性越强,电负性越大,非金属性:O>C>H。
(1)碳元素的原子序数为6,基态碳原子的价层电子排布为2s22p2,则价电子轨道表达式为 ,故答案为:
,故答案为: ;
;
(2)六炔基苯分子中苯环上的原子在同一平面,碳碳三键上原子在同一直线上,则六炔基苯分子中的所有原子能在同一平面上;由结构简式可知,六炔基苯分子的结构对称,属于非极性分子;苯环中含有6个![]() 键,苯环中的碳原子与碳碳三键相连的碳原子形成
键,苯环中的碳原子与碳碳三键相连的碳原子形成![]() 键,碳碳三键中含有1个
键,碳碳三键中含有1个![]() 键,碳原子和氢原子形成
键,碳原子和氢原子形成![]() 键,则1个六炔基苯分子中含有6个碳氢
键,则1个六炔基苯分子中含有6个碳氢![]() 键和18个碳碳
键和18个碳碳![]() 键,
键,![]() 键的数目为24,故答案为:能;非极性,24;
键的数目为24,故答案为:能;非极性,24;
(3)由题给示意图可知,多壁碳纳米管的结构类似于石墨晶体,则每个碳原子通过sp2杂化与周围碳原子成键,T-碳的结构类似于甲烷,则每个碳原子通过sp3杂化与周围碳原子成键;元素的非金属性越强,电负性越大,非金属性:O>C>H,则溶剂甲醇中三种元素的电负性由大到小的顺序为O>C>H,故答案为:sp2;sp3;O>C>H。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
【题目】“清肺排毒汤”来源于中医经典方剂组合,对新冠肺炎病毒感染的轻型、普通型的治疗具有良好的效果。其中的一味中药黄芩,其有效成分黄芩苷的结构简式如下图所示,下列有关黄芩苷的说法中正确的是( )
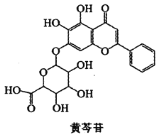
A.属于芳香族化合物,分子式为![]()
B.分子中苯环上的一氯代物有4种
C.可发生取代反应、加成反应,不能发生氧化反应
D.与足量![]() 发生加成反应后,官能团种类减少1种
发生加成反应后,官能团种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面四个反应中,反应类型与其它三个不同的是
A.CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
B.CH3CH2Br+NaOH![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
C.C6H5OH+3Br2 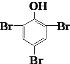 +3HBr
+3HBr
D.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氯化氢为原料通过直接氧化法可以制取氯气,反应方程式为:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) 。
(1)该法可按下列催化过程进行:
CuCl2(s)CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol-1
Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+![]() O2(g)CuO(s)+
O2(g)CuO(s)+![]() Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
①总反应4HCl(g)+O2(g)2Cl2(g)+2H2O(g)的ΔH=____kJ·mol-1。
②有利于提高总反应平衡产率的条件有______。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)恒温恒压下,可以说明总反应4HCl(g)+O2(g)2Cl2(g)+2H2O(g)达到平衡的是_________。
A.压强不变
B.氯气的体积分数保持不变
C.每生成2个H—O的同时,有4个H—Cl生成
D.反应速率v正(O2)∶v逆(H2O)=1∶2
E.各组分的物质的量浓度都相等

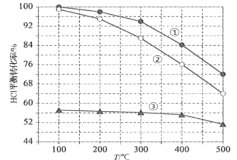
(3)密闭容器中充入HCl和O2进行反应,c(HCl)随时间t的变化曲线如图1,保持其他条件不变,t2时升温,t3时重新达平衡,画出t2—t4时c(Cl2)随时间t的变化曲线____。
(4)在刚性容器中,进料浓度比c(HCl) ∶c(O2)分别等于1∶1、4∶1、7∶1时,HCl平衡转化率随温度变化的关系如图2:
①其中曲线①代表的c(HCl) ∶c(O2)是__________,原因__________。
②设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=4∶1的数据计算K(400℃)=__________(列出计算式,不必算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化硼![]() 是一种具有超高热导率的新型半导体材料,其制备原理为
是一种具有超高热导率的新型半导体材料,其制备原理为![]() 。下列说法错误的是( )
。下列说法错误的是( )
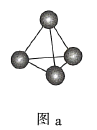

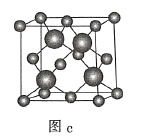
A.图a表示![]() 结构,
结构,![]() 分子中成键电子对与孤电子对的数目之比为3:1
分子中成键电子对与孤电子对的数目之比为3:1
B.图b表示晶态单质硼![]() 的基本结构单元,该基本结构单元为正二十面体
的基本结构单元,该基本结构单元为正二十面体
C.图c表示![]() 晶胞结构,
晶胞结构,![]() 原子的配位数为4
原子的配位数为4
D.该反应所涉及的元素中,I的原子半径最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光呼吸是所有进行光合作用的细胞在光照和高氧低二氧化碳情况下发生的一个代谢过程。它是光合作用一个损耗能量的副反应。即绿色植物在照光条件下的呼吸作用。特点是有机物在被分解转化过程中虽也放出CO2,但不能生成ATP,使光合产物被白白地耗费掉。所以光呼吸越强,光合生产率相对就低。
光呼吸现象产生的分子机制是O2和CO2竞争Rubisco酶。在暗反应中,Rubisco酶能够以CO2为底物实现CO2的固定,而当O2浓度高、CO2浓度低时,O2会竞争Rubisco酶。Rubisco酶以O2为底物,对五碳化合物进行加氧氧化。光呼吸使光合作用产物损失的具体过程如图所示。
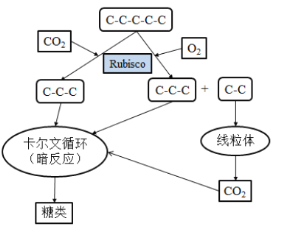
水稻、小麦等C3植物的光呼吸显著,通过光呼吸损耗光合作用新形成有机物的1/4,而高粱、玉米等C4植物的光呼吸消耗很少,只占光合作用新形成有机物的2%~5%。与C3植物相比,C4植物代谢的不同点是,C4植物叶肉细胞的细胞质基质具有一种特殊的PEP羧化酶,它催化如下反应:PEP+HCO3—→苹果酸(C4)+Pi。苹果酸进入维管束鞘细胞,生成CO2用于暗反应,再生出的丙酮酸(C3)回到叶肉细胞中,进行循环利用。叶肉细胞包围在维管束鞘细胞四周,形成花环状结构。PEP羧化酶与CO2的亲和力是Rubisco酶的60倍,也就是PEP羧化酶能固定低浓度的CO2。

水稻和小麦作为养活全世界几乎40%人口的主要作物,它们的产量近几年越来越难满足全球快速增长的食物需求。目前,国际上有很多科研人员致力于提高水稻、小麦的光合速率的研究,旨在提高粮食作物产量。
(1)在光呼吸过程中,有机物被氧化分解,却无ATP生成,而ATP能应用于___________________(写出三条)等生命活动中,故会造成有机物浪费的结果。
(2)有观点指出,光呼吸的生理作用在于高温天气和过强光照下,蒸腾作用过强,植物失水过多,____________大量关闭,导致CO2供应减少。此时的光呼吸可以消耗光反应阶段生成的多余的____________,并且光呼吸的最终产物还可以作为暗反应阶段的原料,这是有重要正面意义的。
(3)综合文中信息,请解释C4植物光呼吸比C3植物小很多的原因__________。
(4)请根据高中所学知识和本文中的信息,在基因水平上写出两条具体的提高水稻、小麦光合作用的研究思路__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W、Z同主族,Y的族序数等于其周期数,X、Y、Z的最外层电子数之和等于10,W、Z形成的一种化合物能使品红溶液褪色。下列说法正确的是( )
A.原子半径:W>X>Y>Z
B.W、X、Y三种元素组成的化合物的水溶液呈中性
C.常温下,Y易溶于Z的最高价氧化物对应的水化物的浓溶液
D.W、X、Z三种元素组成的某种化合物与盐酸反应时,可能有单质Z析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)第四周期中,未成对电子数最多的元素是________,(填名称)它位于第________族;核外电子排布式是__________________。它有________种运动状态不同的电子,其价电子排布图为:______________。
(2)已知NH5为离子化合物,写出其电子式:________。
(3)某同学根据掌握的知识分析Mg的核外电子排布为![]() 。该同学所画的电子排布图违背了________。
。该同学所画的电子排布图违背了________。
(4)在基态 14C原子中,核外存在________对自旋相反的电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铬(CrN)薄膜具有韧性高、耐磨性好、涂层结合强度高、更好的抗高温氧化性和抗腐蚀性以及内应力低等优点,在汽车工业、航空航天等领域取得了很好的应用效果。某化学兴趣小组利用下列装置进行氮化铬的制备(部分夹持装置已略),回答下列问题:
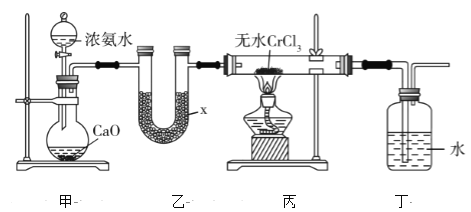
(1)仪器x的名称为________,x中盛有的试剂为干燥剂,该干燥剂可以是________(填字母)。
a.浓硫酸 b.碱石灰 c.CaO d.无水CaCl2
(2)装置甲中CaO可用NaOH固体代替,其原因是_______________________________________________。
(3)若装置丙玻璃管中产生大量白烟,则发生反应的化学方程式为__________________________________。
(4)装置丁洗气瓶中水的作用是________________________________________。该装置是否合适?合适则写出合适的理由,不合适则说明改进措施:_____________________________________________________
(5)实验前,在装置丙中加入15.850g CrCl3,实验结束后,取出装置丙中的固体加热至质量不再减少,称量剩余固体质量为7.525g,则制备的产品纯度为______%(保留小数点后一位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com