
����Ŀ������������Ԫ��W��X��Y��Z��ԭ��������������W��Zͬ���壬Y����������������������X��Y��Z������������֮�͵���10��W��Z�γɵ�һ�ֻ�������ʹƷ����Һ��ɫ������˵����ȷ���ǣ�������
A.ԭ�Ӱ뾶��W��X��Y��Z
B.W��X��Y����Ԫ����ɵĻ������ˮ��Һ������
C.�����£�Y������Z������������Ӧ��ˮ�����Ũ��Һ
D.W��X��Z����Ԫ����ɵ�ij�ֻ����������ᷴӦʱ�������е���Z����
���𰸡�D
��������
���������Ϣ��W��X��Y��ZΪԭ��������������Ķ���������Ԫ�أ�W��Zͬ���壬W��Z�γɵ�һ�ֻ�������ʹƷ����Һ��ɫ����û�����ΪSO2��WΪOԪ�أ�ZΪSԪ�أ�Y������������������������YΪAlԪ�أ�X��Y��Z������������֮�͵���10����X������������Ϊ10-3-6=1������XΪNaԪ�أ��ݴ˷������
��������������֪��WΪO��XΪNa��YΪAl��ZΪS��
A��ͬ����Ԫ��ԭ�Ӱ뾶�����������μ�С��ͬ����Ԫ�����϶���ԭ�Ӱ뾶����������ԭ�Ӱ뾶��Na��Al��S��O��Aѡ�����
B��O��Na��Al����Ԫ����ɵĻ�����ΪNaAlO2����ˮ��Һ��![]() ˮ���Լ��ԣ�Bѡ�����
ˮ���Լ��ԣ�Bѡ�����
C��S������������Ӧˮ�����Ũ��ҺΪŨ���ᣬ������Al��Ũ�����ۻ���Cѡ�����
D��O��Na��S����Ԫ����ɵ�Na2S2O3�����ᷴӦʱ���ᷢ���绯��Ӧ����SO2�����S���ʣ�Dѡ����ȷ��
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����շ���[Mn(H2PO4)2��H2O]��Ҫ���������������̿�(��Ҫ�ɷ�ΪMnO2��������FeO��Al2O3��SiO2)Ϊԭ���Ʊ����շ��ε���Ҫ����������ͼ��
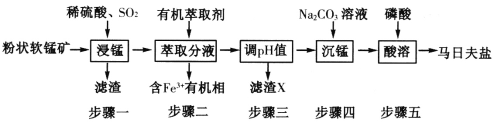
(1)���������������ɣ����շ���[Mn(H2PO4)2��2H2O]�Ļ�ѧ����Ϊ______���ڷ�Ӧ�У�Mn2+����ʧȥһ�����ӱ�Fe2+��ʧȥһ�������ѣ���ԭ�ӽṹ������ԭ��_______��
(2)����������������Ҫ��Ӧ�����ӷ���ʽΪ_______������X��Ҫ�ɷ�Ϊ_________������������������ɵ�ʵ�������������_________��������������շ��ξ���Ļ�ѧ����ʽΪ_________��
(3)Fe3+����ȡ������Һ��pH�ͽӴ�ʱ��֮��Ĺ�ϵ��ͼ���ݴ˷�������ȡ���������Ϊ__________��

(4)���շ���������������ԭ�����������ǿ�������Լ��ڷ���������������˾��б������õ�FeHPO4�����շ��������Ե���Ҫԭ����__________(����ػ�ѧ����ش�)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.MCl2��ˮ��Һ�еĵ��뷽��ʽΪ��MCl2=M2����2Cl����M(OH)2�������������
B.������п�ֱ�����������pH������ʹ��ᷴӦ����ͬ�����²������������ͬ
C.��֪��H2A=H����HA��HAH+��A2����NaHA��Һ������
D.��ͬ�¶��£�pH��ȵİ�ˮ������������Һ�У�c(NH![]() )��c(Na+)
)��c(Na+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��ͬ���������кܶ࣬�ҹ���ѧ�ҳɹ��غϳ���ͨ�����ۼ���Ԥ�Ե�T-̼���ش��������⣺
��1����̬̼ԭ�Ӽ۲���ӵĹ������ʽ�������Ų�ͼ��Ϊ________��
��2��ʯīȲ������Ȳ����![]() ��ͭƬ�Ĵ������·���ż����Ӧ�õ���
��ͭƬ�Ĵ������·���ż����Ӧ�õ���
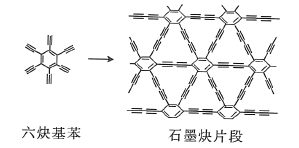
��Ȳ���������е�����ԭ��________��������������������������ͬһƽ�棬��Ȳ��������________�����������������Ǽ����������ӣ�1����Ȳ���������к���![]() ������ĿΪ________��
������ĿΪ________��
��3�����ʯ��ͼ1���е�ÿ��̼ԭ����һ����4��̼ԭ����ɵ���������Ľṹ��Ԫ��ͼ2��ȡ�������õ�T-̼��T-̼��ͨ��Ƥ�뼤�����������ڼ״���Һ�еĶ��̼���ܣ�ͼ3���Ƶá����̼���ܺ�T-̼��̼ԭ�ӵ��ӻ���ʽ����Ϊ________��________���ܼ��״�������Ԫ�صĵ縺���ɴ�С��˳��Ϊ________����Ԫ�ط��ű�ʾ����
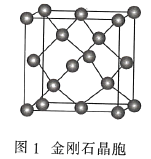
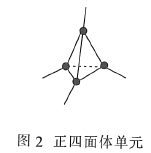
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA ���������ӵ�������ֵ������������ȷ����
A.��״���£�2.24 L Cl2 ������� NaOH ��Һ��Ӧ��ת�Ƶ�����Ϊ 0.2 NA
B.5��ʱ��pH��12 �İ�ˮ������ OH������ĿΪ 0.01 NA
C.1 mol �ǻ��к��еĵ�����Ϊ 10 NA
D.7.8 g Na2O2 ����������������Ϊ 0.3 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ͭ�����̿����Ҫ�ɷ����±���ʾ��
��ʯ | ��ͭ�� | ���̿� |
��Ҫ�ɷ� | Cu2S��Fe2O3��SiO2 | MnO2��SiO2 |
ij���������������ֿ�ʯΪԭ�ϲ���ʪ��ұ��ͭ���������£�
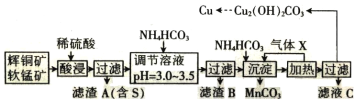
�ش��������⣺
(1)���� X ��Ũ������������̡���д������ X �ĵ���ʽ��______________________________��
(2)��ߡ���������ʵĴ�ʩ��______________________________(������)��
(3)�����ӷ���ʽ��ʾ��������� MnO2 �����ã�______________________________����������Ԫ����______________________________(��Ԫ�ط���)��
(4)��֪ CH3COONH4 ��Һ�����ԣ������£�NH4HCO3 ��Һ pH______________________________(���������<����=��)7��������__________��
(5)����Һ C �п�����ȡһ�ֻ�ѧ���ϣ����Ļ�ѧʽΪ_____________________________��
(6) ����Һ�������ļ�ʽ̼��ͭ���ܴ��нᾧˮ������ͨʽΪ Cu2(OH)2CO3��xH2O��ȷ��ȡa g ��Ʒ�����������أ��Ƶ� CuO �������������������� b g���� x Ϊ______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ͽ����ұ���������ϩ��![]()
![]() ������˵����ȷ����(����)
������˵����ȷ����(����)
A.�������Ը��������Һ�����ұ��ͱ���ϩ
B.����ϩ��ʹ��ˮ��ɫ������Ϊ���߷����˼ӳɷ�Ӧ
C.�ұ��ͱ���ϩ�����ϵ�һ�ȴ����Ϊ3��
D.�ұ��ͱ���ϩ�����ڹ�ƽ���̼ԭ��������Ϊ7��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ؾ���Kx[Fe(C2O4)y]��3H2O��һ�ֹ������ϣ�������һ���Ʊ����������ؾ����ʵ�����̡�
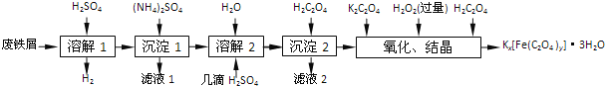
��֪��(NH4)2SO4��FeSO4��7H2O��Ī����[(NH4)2SO4��FeSO4��6H2O]���ܽ�������
�¶�/�� | 10 | 20 | 30 | 40 | 50 |
(NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO4��7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | �D |
(NH4)2SO4��FeSO4��6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)����м�ڽ��С��ܽ�1��ǰ��������5% Na2CO3��Һ�м��������ӣ���ϴ�Ӹɾ���Na2CO3��Һ��������________��
(2)���ܽ�1��Ӧ��֤��м�Թ�������Ŀ����___________�����ܽ�2���ӡ�����H2SO4����������________��
(3)�����ֽ⡱�Ʊ�Ī���ξ���Ļ���ʵ�鲽���ǣ�����Ũ����________�����ˡ����Ҵ�ϴ�ӡ�������Ҵ�ϴ�ӵ�Ŀ����____________��
(4)��������ʱ�õ���FeC2O4��2H2O��������ˮϴ�Ӹɾ�����������Ƿ�ϴ�Ӹɾ��ķ�����_______��
(5)���ᾧ��Ӧ����Һ���ںڰ����ȴ����������������������ԭ����__________��
(6)�벹ȫ�ⶨ���������ز�Ʒ��Fe3��������ʵ�鲽��[��ѡ�Լ���KMnO4��Һ��п�ۡ����ۡ�NaOH��Һ��
����1��ȷ��ȡ���Ʊ��IJ��������ؾ���a g�����250 mL����Һ��
����2������Һ����ȡ25.00 mL����Һ����ƿ�У�����ϡH2SO4�ữ��_________��C2O42-ת��ΪCO2����ȥ��
����3������2������Һ��______________��
����4����c mol��L��1 KMnO4����Һ�ζ�����3������Һ���յ㣬����V mL KMnO4����Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݷ�Ӧ������(H+)��ת�ƣ��������¶�����ͼ��=����+(����)�������֮����ڱ˴˵Ĺ����ϵ��HA+BA-+BH+�����ڷ�Ӧ��HC2O4��+H3O+![]() H2C2O4+H2O��HC2O4��+OH-
H2C2O4+H2O��HC2O4��+OH-![]() C2O42��+H2O�������ж���ȷ����
C2O42��+H2O�������ж���ȷ����
A. HC2O4���Ĺ����ΪH2C2O4
B. HC2O4���Ĺ�����ΪC2O42��
C. HC2O4���������������
D.H3O+��ˮ�Ĺ���H2O��OH-�Ĺ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com