
����Ŀ����֪��ͭ�����̿����Ҫ�ɷ����±���ʾ��
��ʯ | ��ͭ�� | ���̿� |
��Ҫ�ɷ� | Cu2S��Fe2O3��SiO2 | MnO2��SiO2 |
ij���������������ֿ�ʯΪԭ�ϲ���ʪ��ұ��ͭ���������£�
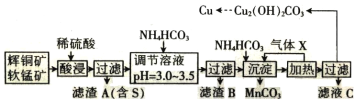
�ش��������⣺
(1)���� X ��Ũ������������̡���д������ X �ĵ���ʽ��______________________________��
(2)��ߡ���������ʵĴ�ʩ��______________________________(������)��
(3)�����ӷ���ʽ��ʾ��������� MnO2 �����ã�______________________________����������Ԫ����______________________________(��Ԫ�ط���)��
(4)��֪ CH3COONH4 ��Һ�����ԣ������£�NH4HCO3 ��Һ pH______________________________(���������<����=��)7��������__________��
(5)����Һ C �п�����ȡһ�ֻ�ѧ���ϣ����Ļ�ѧʽΪ_____________________________��
(6) ����Һ�������ļ�ʽ̼��ͭ���ܴ��нᾧˮ������ͨʽΪ Cu2(OH)2CO3��xH2O��ȷ��ȡa g ��Ʒ�����������أ��Ƶ� CuO �������������������� b g���� x Ϊ______________________________��
���𰸡�![]() �ʵ����������Ũ�ȡ��ʵ������¶ȡ�����ʯ��������Ӵ�������߽��н��裨�������֣�
�ʵ����������Ũ�ȡ��ʵ������¶ȡ�����ʯ��������Ӵ�������߽��н��裨�������֣� ![]() Cu��S ��
Cu��S �� ![]() ��ˮ��̶ȴ���
��ˮ��̶ȴ���![]() (NH4)2SO4
(NH4)2SO4 ![]()
��������
���̷�����֪��ͭ�����̿�������������Cu2S+2MnO2+8H+=2Cu2++S��+2Mn2++4H2O��Fe2O3+6H+=2Fe3++3H2O��SiO2���ܣ����˵õ�����AΪS��SiO2���õ�����Һ������ҺPH��ʹ������ȫ������������BΪ�������������˵õ�����Һ����Ҫ����CuSO4��MnSO4�ȣ�����̼����狀Ͳ�ͨ�백�������˵õ�����ΪMnCO3��������Һ���ȸϳ��������ᾧ�����õ���ʽ̼��ͭ�����˵õ����ٽ���ҺCͨ������Ũ������ȴ�ᾧ����ϴ�Ӹ���õ����ᰱ���壬�ݴ˷�������
(1)�������� X ��Ũ������������̡�������ͼ������Ԫ�صĹ�ϵ��������֪����XӦ��ΪNH3�������ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(2)��ߡ���������ʵĴ�ʩ���ʵ����������Ũ�ȡ��ʵ������¶ȡ�����ʯ��������Ӵ�������߽��н�����ʵ�֣��ʴ�Ϊ���ʵ����������Ũ�ȡ��ʵ������¶ȡ�����ʯ��������Ӵ�������߽��н��裨�������֣�
(3) ��������ͼ�п�֪�����Cu2S������������������S���ʺ�Cu2+���ʿ�֪MnO2����Cu2S��Ӧ���������ӷ���ʽ![]() ��ʾ���������MnO2�����ã���Ӧ�б�������Ԫ����Cu��S���ʴ�Ϊ��
��ʾ���������MnO2�����ã���Ӧ�б�������Ԫ����Cu��S���ʴ�Ϊ�� ![]() Cu��S��
Cu��S��
(4)��֪CH3COONH4��Һ�����ԣ���˵��CH3COO-��![]() ��ˮ��̶��൱������CH3COOH�����Ա�H2CO3ǿ����
��ˮ��̶��൱������CH3COOH�����Ա�H2CO3ǿ����![]() ��ˮ��̶ȴ���CH3COO-��Ҳ�ʹ���
��ˮ��̶ȴ���CH3COO-��Ҳ�ʹ���![]() ���������£�NH4HCO3��Һ pH��7���ʴ�Ϊ������
���������£�NH4HCO3��Һ pH��7���ʴ�Ϊ������![]() ��ˮ��̶ȴ���
��ˮ��̶ȴ���![]() ��
��
(5)������������ͼ���ѵó�����Һ C��Ҫ����(NH4)2SO4�����������ʣ������Ļ�ѧʽΪ(NH4)2SO4���ʴ�Ϊ��(NH4)2SO4��
(6) ����ȷ��ȡa g ��Ʒ�����������أ��Ƶ� CuO �������������������� b g����CuO ������Ϊ(a-b)g����![]() ���ʸ���ͭԭ���غ��У�
���ʸ���ͭԭ���غ��У�![]() �����Ժ��еĽᾧˮ�����ʵ���Ϊ��
�����Ժ��еĽᾧˮ�����ʵ���Ϊ��![]() �����������غ��У�m(H2O)+m[Cu2(OH)2CO3]=ag������
�����������غ��У�m(H2O)+m[Cu2(OH)2CO3]=ag������![]() ���������ݵã�
���������ݵã�![]() ����ã�x=
����ã�x=![]() �ʴ�Ϊ��
�ʴ�Ϊ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ�������ʵ�ı�����ȷ����
A.���CuCl2��Һ��CuCl2=Cu2++2Cl-
B.Mg��Cl�γ����Ӽ��Ĺ��̣�![]()
C.��Al2(SO4)3��Һ�еμ�Na2CO3��Һ��2Al3++3CO32-=Al2(CO3)3��
D.�������Ҵ�����������Ӧ��CH3COOH+C2H518OH![]() CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���Ϊԭ��ͨ��ֱ��������������ȡ��������Ӧ����ʽΪ��4HCl(g)��O2(g) 2Cl2(g)��2H2O(g) ��
(1)�÷��ɰ����д����̽��У�
CuCl2(s)CuCl(s)��![]() Cl2(g) ��H1��83 kJ��mol-1
Cl2(g) ��H1��83 kJ��mol-1
CuCl(s)��![]() O2(g)CuO(s)��
O2(g)CuO(s)��![]() Cl2(g) ��H2����20 kJ��mol-1
Cl2(g) ��H2����20 kJ��mol-1
CuO(s)��2HCl(g)=CuCl2(s)��H2O(g) ��H3����121 kJ��mol-1
���ܷ�Ӧ4HCl(g)��O2(g)2Cl2(g)��2H2O(g)����H��____kJ��mol-1��
������������ܷ�Ӧƽ����ʵ�������______��
A������ B������ C����ѹ D����ѹ E������
(2)���º�ѹ�£�����˵���ܷ�Ӧ4HCl(g)��O2(g)2Cl2(g)��2H2O(g)�ﵽƽ�����_________��
A��ѹǿ����
B������������������ֲ���
C��ÿ����2��H��O��ͬʱ����4��H��Cl����
D����Ӧ����v��(O2)��v��(H2O)��1��2
E������ֵ����ʵ���Ũ�ȶ����

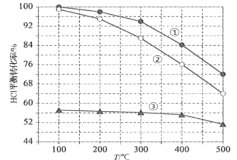
(3)�ܱ������г���HCl��O2���з�Ӧ��c(HCl)��ʱ��t�ı仯������ͼ1�����������������䣬t2ʱ���£�t3ʱ���´�ƽ�⣬����t2��t4ʱc(Cl2)��ʱ��t�ı仯����____��
(4)�ڸ��������У�����Ũ�ȱ�c(HCl) ��c(O2)�ֱ����1��1��4��1��7��1ʱ��HClƽ��ת�������¶ȱ仯�Ĺ�ϵ��ͼ2��
���������ߢٴ�����c(HCl) ��c(O2)��__________��ԭ��__________��
����HCl��ʼŨ��Ϊc0�����ݽ���Ũ�ȱ�c(HCl)��c(O2)=4��1�����ݼ���K(400��)��__________(�г�����ʽ������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������н��й�����õ�ϸ���ڹ��պ����Ͷ�����̼����·�����һ����л���̡����ǹ������һ����������ĸ���Ӧ������ɫֲ�����չ������µĺ������á��ص����л����ڱ��ֽ�ת����������Ҳ�ų�CO2������������ATP��ʹ��ϲ��ﱻ�װغķѵ������Թ����Խǿ�������������Ծ͵͡�
�������������ķ��ӻ�����O2��CO2����Rubiscoø���ڰ���Ӧ�У�Rubiscoø�ܹ���CO2Ϊ����ʵ��CO2�Ĺ̶�������O2Ũ�ȸߡ�CO2Ũ�ȵ�ʱ��O2�Ὰ��Rubiscoø��Rubiscoø��O2Ϊ�������̼��������м��������������ʹ������ò�����ʧ�ľ��������ͼ��ʾ��
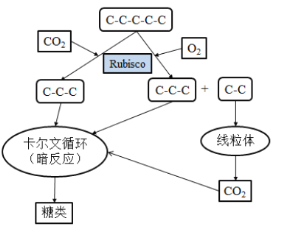
ˮ����С���C3ֲ��Ĺ����������ͨ���������Ĺ���������γ��л����1/4��������������C4ֲ��Ĺ�������ĺ��٣�ֻռ����������γ��л����2%~5%����C3ֲ����ȣ�C4ֲ���л�IJ�ͬ���ǣ�C4ֲ��Ҷ��ϸ����ϸ���ʻ��ʾ���һ�������PEP�Ȼ�ø���������·�Ӧ��PEP+HCO3����ƻ���ᣨC4��+Pi��ƻ�������ά������ϸ��������CO2���ڰ���Ӧ���������ı�ͪ�ᣨC3���ص�Ҷ��ϸ���У�����ѭ�����á�Ҷ��ϸ����Χ��ά������ϸ�����ܣ��γɻ���״�ṹ��PEP�Ȼ�ø��CO2��������Rubiscoø��60����Ҳ����PEP�Ȼ�ø�̶ܹ���Ũ�ȵ�CO2��

ˮ����С����Ϊ����ȫ���缸��40%�˿ڵ���Ҫ������ǵIJ���������Խ��Խ������ȫ�����������ʳ������Ŀǰ���������кܶ������Ա���������ˮ����С��Ĺ�����ʵ��о���ּ�������ʳ���������
��1���ڹ���������У��л��ﱻ�����ֽ⣬ȴ��ATP���ɣ���ATP��Ӧ����___________________��д����������������У��ʻ�����л����˷ѵĽ����
��2���й۵�ָ����������������������ڸ���������ǿ�����£��������ù�ǿ��ֲ��ʧˮ���࣬____________�����رգ�����CO2��Ӧ���١���ʱ�Ĺ�����������ĹⷴӦ�����ɵĶ����____________�����ҹ���������ղ��ﻹ������Ϊ����Ӧ�ε�ԭ�ϣ���������Ҫ��������ġ�
��3���ۺ�������Ϣ�������C4ֲ��������C3ֲ��С�ܶ��ԭ��__________��
��4������ݸ�����ѧ֪ʶ�ͱ����е���Ϣ���ڻ���ˮƽ��д��������������ˮ����С�������õ��о�˼·__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��W��X��Y��Z��ԭ��������������W��Zͬ���壬Y����������������������X��Y��Z������������֮�͵���10��W��Z�γɵ�һ�ֻ�������ʹƷ����Һ��ɫ������˵����ȷ���ǣ�������
A.ԭ�Ӱ뾶��W��X��Y��Z
B.W��X��Y����Ԫ����ɵĻ������ˮ��Һ������
C.�����£�Y������Z������������Ӧ��ˮ�����Ũ��Һ
D.W��X��Z����Ԫ����ɵ�ij�ֻ����������ᷴӦʱ�������е���Z����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���ȷ���ǣ� ��
A.Na��Mg��Al��δ�ɶԵ�������������
B.�۵����Ų�Ϊ4s24p3��Ԫ��λ�ڵ������ڵڢ�A�壬��p��Ԫ��
C.2p��3p�����״��Ϊ�����Σ�����Ҳ���
D.��ԭ�ӵ����������Ų�ͼ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)���������У�δ�ɶԵ���������Ԫ����________��(������)��λ�ڵ�________�壻��������Ų�ʽ��__________________������________���˶�״̬��ͬ�ĵ��ӣ���۵����Ų�ͼΪ��______________��
(2)��֪NH5Ϊ���ӻ����д�������ʽ��________��
(3)ijͬѧ�������յ�֪ʶ����Mg�ĺ�������Ų�Ϊ![]() ����ͬѧ�����ĵ����Ų�ͼΥ����________��
����ͬѧ�����ĵ����Ų�ͼΥ����________��
(4)�ڻ�̬ 14Cԭ���У��������________�������෴�ĵ��ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CPAE�Ƿ佺����Ҫ���Գɷ֣�Ҳ���ɿ�����ϳɣ�����˵������ȷ���ǣ� ��
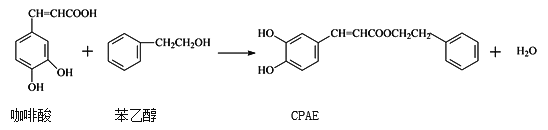
A. 1mol CPAE����������ˮ��Ӧ���������4mol Br2
B. ������ɷ����ۺϷ�Ӧ������������к���3�ֹ�����
C. �뱽�Ҵ���Ϊͬ���칹��ķ������ʹ���9��
D. ���ý���Na���������Ӧ�Ƿ�������Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����⻯��NaBH4(BԪ�صĻ��ϼ�Ϊ+3��)ȼ�ϵ��(DBFC), ���ھ���Ч�ʸߡ������������Ⱦ��ȼ�����ڴ����������ŵ㣬����Ϊ��һ�ֺ��з�չDZ����ȼ�ϵ�ء��乤��ԭ������ͼ��ʾ������˵����ȷ����
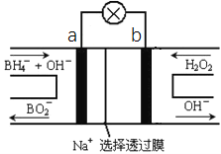
A. ��صĸ�����ӦΪBH4��+2H2O��8e��=BO2��+8H+
B. �ŵ�ʱ��ÿת��2mol���ӣ���������Ҫ����9.5gNaBH4
C. ��طŵ�ʱNa+��b��������a����
D. �缫a����MnO2��MnO2�����缫�������д�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com