
【题目】溴化碘(IBr)的化学性质类似于卤素单质,试完成下列问题:
(1)溴化碘的电子式是 ,它是由 键形成的 分子.
(2)溴化碘和水反应生成了一种三原子分子,该分子的电子式为 .
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.甲烷、乙烯和苯在工业上都可以通过石油分馏得到
B.煤中含有苯、甲苯、二甲苯等有机物,可通过干馏分离出这些物质
C.甲烷、乙烯、乙醇都能发生氧化反应
D.汽油、柴油属于烃,植物油属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属冶炼和处理常涉及氧化还原反应.
(1)由下列物质冶炼相应金属时采用电解法的是
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol.向CuSO4溶液中加入镁条时有气体生成,该气体是
(3)下图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为
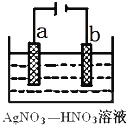
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.
(1)从能量的角度看,断开化学键要 (填“放出”或“吸收”)能量.已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、300kJ.则由H2和I2反应生成1mol HI需要 (填“放出”或“吸收”) kJ的热量.
(2)某兴趣小组为研究原电池原理,设计如图1装置:
①a和b用导线连接,Zn发生 (填“氧化”或“还原”)反应.其电极反应式为 .溶液H+移向 (填“Cu”或“Zn”)极.
②无论a和b是否连接,Zn片均被腐蚀.若转移了0.4mol电子,则理论上Zn片质量减轻 g.
(3)①目前常用的镍(Ni)镉(Cd)电池其电池总反应式可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是 (填序号).
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是 (填序号).
a.以上反应是可逆反应
b.充电时化学能转变为电能
c.放电时化学能转变为电能
②图2为氢氧燃料电池的构造示意图,根据电子运动方向可知,则X极为电池的 (填“正”或“负”)极,Y极的电极反应方程式为 .

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种化合物的结构示意图,请根据图解回答下面的问题:

(1)该化合物的具体名称是 ,组成该化合物的基本结构单位是 ,其结构特点是 。
(2)该化合物的基本连接键是 ,由一个 与另一个 脱去一分子 形成的。
(3)如果该化合物的相对分子质量是a,则组成该化合物的基本单位的平均相对分子质量是 ,若R1、R2、R3既可以相同也可以不同,理论上生物体可以形成 种上图所示化合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)检验FeCl3溶液中阳离子的方法是
(2)FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)
FeCl3溶液也常用于腐蚀印刷电路板,反应的离子方程式为
(3)通过控制条件,将FeCl3水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O ![]() Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是 (填序号)。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是 (填序号)。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
(4)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3。完成NaClO3 氧化FeCl2 的离子方程式 。
(5)处理废水时,发现FeCl3并不能使酸性废水中的悬浮物沉降除去,其原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液组成的描述合理的是 ( )
A. 漂白粉的水溶液可能大量存在Fe2+、Cl-、Ca2+、Na+
B. 滴加石蕊呈红色的溶液可能大量存在K+、NH4+、Cl-、S2﹣
C. 与Al反应能放出H2的溶液中可能大量存在:Fe2+、K+、NO![]() 、SO
、SO![]()
D. 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A. 用KIO3氧化酸性溶液中的KI: 5I-+IO3-+3H2O=3I2+6OH-
B. 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
C. 将过量SO2通入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+
D. 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com