
【题目】金属冶炼和处理常涉及氧化还原反应.
(1)由下列物质冶炼相应金属时采用电解法的是
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol.向CuSO4溶液中加入镁条时有气体生成,该气体是
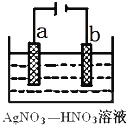
(3)下图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 .
【答案】(1)bd;
(2)Cu2S;4;氢气;
(3)a;NO3﹣+e﹣+2H+=NO2↑+H2O;
(4)作电解质溶液,形成原电池.
【解析】
试题分析:(1)电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);热分解法:Hg、Ag用加热分解氧化物的方法制得,物理分离法:Pt、Au用物理分离的方法制得;
(2)失电子化合价升高的反应物是还原剂,根据得失电子相等计算失去电子的物质的量,硫酸铜溶液呈酸性,镁和酸反应生成氢气;
(3)电解精炼银时,粗银作阳极,若b极有少量红棕色气体生成,则b电极上硝酸根离子得电子生成二氧化氮;
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,该装置构成原电池,食盐水作电解质溶液,促进溶液的导电性.
解:(1)活泼金属采用电解法冶炼,钠、铝都是活泼金属,采用电解熔融态NaCl、Al2O3的方法冶炼,故选bd;
(2)在该反应中,Cu元素化合价由+1升高到+2,S元素由﹣2升高到+6,所以Cu2S做还原剂;
氧化还原反应中得失电子数相等,所以当有1molO2参与反应时失去4mol电子,则还原剂所失电子的物质的量为4mol;
硫酸铜是强酸弱碱盐,其溶液呈酸性,镁和酸反应生成氢气,
故答案为:Cu2S;4;氢气;
(3)电解精炼时,粗银做阳极,所以粗银是a极;
b电极是阴极,发生还原反应,生成了红棕色气体是NO2,电极反应:NO3﹣+e﹣+2H+=NO2↑+H2O,
故答案为:a;NO3﹣+e﹣+2H+=NO2↑+H2O;
(4)该装置构成原电池,氯化钠溶液作电解质溶液,促进溶液的导电能力,故答案为:作电解质溶液,形成原电池.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】难溶于水而且比水轻的含氧有机物是
①硝基苯 ②苯 ③溴苯 ④植物油 ⑤乙醇 ⑥乙酸乙酯 ⑦乙酸
A. ②④⑥⑦ B. ①②③④⑤ C. ④⑥ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在水溶液中大量共存的是
A.Ca2+、SO42-、H+、HCO3- B.H+、NO3-、Cl-、SiO32-
C.K+、Fe2+、H+、NO3- D.K+、Na+、CO32-、SiO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性干电池装置示意图如图,电池总反应为:Zn+2NH4+═Zn2++2NH3↑+H2↑,下列说法正确的是( )
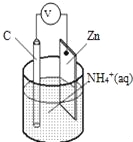
A.碳为电池的负极
B.氨气在碳棒上生成
C.电流由锌极流向碳极
D.H2在Zn片上生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确解释下列反应原理,并书写正确的离子方程式的是( )
A.用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+
B.用小苏打治疗胃酸过多:CO![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.用氯化铁溶液腐蚀印刷线路板上的铜:Fe3++Cu=Fe2++Cu2+
D.用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO![]() =CaCO3+SO
=CaCO3+SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,写出该反应的化学方程式 ,CeO2在该反应中作__________剂。
(2)自然界中Cr主要以+3价和+6价存在,+6价的Cr能引起细胞的突变。现用亚硫酸钠溶液与0.1mol K2Cr2O7反应,将其+6价的Cr完全还原为+3价的铬,则消耗1mol/L亚硫酸钠溶液的体积为 L。
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下:
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质(已知溶解度FeS>CuS)。请写出除去Cu2+的离子方程式 。
②对滤液Ⅱ先加H2O2再调pH。加H2O2的目的是 ,调pH的目的是 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化碘(IBr)的化学性质类似于卤素单质,试完成下列问题:
(1)溴化碘的电子式是 ,它是由 键形成的 分子.
(2)溴化碘和水反应生成了一种三原子分子,该分子的电子式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究影响化学反应速率的影响因素,将等质量的铁与过量盐酸反应,其他实验条件见下表。其中铁被反应完消耗时间最少的组别是
组别 | c(HCl)/ mol·L-1 | 温度/℃ | 铁的状态 |
A | 2.0 | 25 | 块状 |
B | 2.5 | 30 | 粉末状 |
C | 2.5 | 50 | 块状 |
D | 2.5 | 50 | 粉末状 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com