
【题目】铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,写出该反应的化学方程式 ,CeO2在该反应中作__________剂。
(2)自然界中Cr主要以+3价和+6价存在,+6价的Cr能引起细胞的突变。现用亚硫酸钠溶液与0.1mol K2Cr2O7反应,将其+6价的Cr完全还原为+3价的铬,则消耗1mol/L亚硫酸钠溶液的体积为 L。
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下:
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质(已知溶解度FeS>CuS)。请写出除去Cu2+的离子方程式 。
②对滤液Ⅱ先加H2O2再调pH。加H2O2的目的是 ,调pH的目的是 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是 。
【答案】(1)2CeO2 + H2O2+ 3H2SO4 = 2Ce2(SO4)3 + O2↑+ 4H2O 氧化
(2)0.3(3)4Na+TiCl4 ![]() Ti+4NaCl
Ti+4NaCl
(4)①FeS+Cu2+=CuS+Fe2+ ②氧化Fe2+;除去Fe3+ ③增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4)
【解析】
试题分析:(1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,H2O2失电子生成氧气,然后根据原子守恒配平,则该反应的化学方程式为2CeO2 + H2O2+ 3H2SO4 = 2Ce2(SO4)3 + O2↑+ 4H2O;该反应中,其中Ce的化合价从+4价降低到+3价,得到电子,因此CeO2在该反应中作氧化剂。
(2)自然界中Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬,亚硫酸钠被氧化生成硫酸钠,则反应的离子方程式为Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O,根据化学方程式,若亚硫酸钠溶液与0.1mol K2Cr2O7反应,则消耗1mol/L的亚硫酸钠的物质的量为0.3mol,体积为0.3L。
(3)工业上在550℃时用钠与四氯化钛反应可制得钛,则氧化产物是氯化钠,因此该反应的化学方程式是4Na+TiCl4 ![]() Ti+ 4NaCl。
Ti+ 4NaCl。
(4)①硫化铜的溶解度小于氯化亚铁,因此氯化亚铁能与铜离子反应生成硫化铜,反应的离子方程式为FeS+Cu2+=CuS+Fe2+。
②由于滤液中含有亚铁离子需要转化为铁离子而除去,因此对滤液Ⅱ先加H2O2的目的是氧化Fe2+,调pH的目的是除去Fe3+。
③由于滤液Ⅲ中硫酸镍的浓度小,因此通过这两步的作用是增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4)。


科目:高中化学 来源: 题型:
【题目】 向50mL 18mol/L的H2SO4溶液中加入足量的铜片并加热,充分反应后,
转移电子的物质的量为( )
A.大于1.80 mol
B.等于0.90 mol
C.在0.90 mol和1.80 mol之间
D.小于0.90 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是
A. 范德华力、范德华力、范德华力 B. 范德华力、范德华力、共价键
C. 范德华力、共价键、共价键 D. 共价键、共价键、共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属冶炼和处理常涉及氧化还原反应.
(1)由下列物质冶炼相应金属时采用电解法的是
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol.向CuSO4溶液中加入镁条时有气体生成,该气体是
(3)下图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为
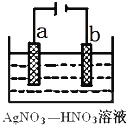
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关表述与图像对应关系不正确的是
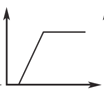



图1 图2 图3 图4
A.图1:往Na2CO3和NaOH混合液中逐滴加入盐酸,产生气体体积与盐酸的物质的量的关系
B.图2:往澄清石灰水中通入过量CO2气体,产生沉淀质量与CO2的物质的量的关系
C.图3:往AlCl3和MgCl2混合液中逐滴加入NaOH溶液,产生沉淀质量与NaOH溶液的物质的量的关系
D.图4:若MOH和ROH表示两种一元碱,则ROH的碱性强于MOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.
(1)从能量的角度看,断开化学键要 (填“放出”或“吸收”)能量.已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、300kJ.则由H2和I2反应生成1mol HI需要 (填“放出”或“吸收”) kJ的热量.
(2)某兴趣小组为研究原电池原理,设计如图1装置:
①a和b用导线连接,Zn发生 (填“氧化”或“还原”)反应.其电极反应式为 .溶液H+移向 (填“Cu”或“Zn”)极.
②无论a和b是否连接,Zn片均被腐蚀.若转移了0.4mol电子,则理论上Zn片质量减轻 g.
(3)①目前常用的镍(Ni)镉(Cd)电池其电池总反应式可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是 (填序号).
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是 (填序号).
a.以上反应是可逆反应
b.充电时化学能转变为电能
c.放电时化学能转变为电能
②图2为氢氧燃料电池的构造示意图,根据电子运动方向可知,则X极为电池的 (填“正”或“负”)极,Y极的电极反应方程式为 .

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种化合物的结构示意图,请根据图解回答下面的问题:

(1)该化合物的具体名称是 ,组成该化合物的基本结构单位是 ,其结构特点是 。
(2)该化合物的基本连接键是 ,由一个 与另一个 脱去一分子 形成的。
(3)如果该化合物的相对分子质量是a,则组成该化合物的基本单位的平均相对分子质量是 ,若R1、R2、R3既可以相同也可以不同,理论上生物体可以形成 种上图所示化合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素形成的化合物A2B3,A3+比B2+少一个电子层,且A3+具有与Ne原子相同的核外电子层结构,下列说法正确的是( )
A. A2B3是三氧化二铝
B. A3+与B2﹣最外层上的电子数相同
C. A是第2周期第ⅢA族的元素
D. B是第3周期第ⅥA族的元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com