
(14��)��ϡ�����У�KMnO4��H2O2�ܷ���������ԭ��Ӧ��
������Ӧ��H2O2��2e��===2H����O2��
��ԭ��Ӧ��MnO��5e����8H��===Mn2����4H2O
(1)д����������ԭ��Ӧ�����ӷ���ʽ��______________________________________��
(2)�÷�Ӧ����������________����������Ԫ����________������0.5 mol H2O2�μӴ˷�Ӧ����ת�Ƶ��Ӹ���Ϊ________��
(3)��KMnO4�������㣬��Mn2���Ĵ������£�H2O2���ֽܷ⣬�ֽⷴӦ�Ļ�ѧ����ʽΪ__________________����ʱ����0.5 mol H2O2�����ֽ⣬��ת�Ƶ��Ӹ���Ϊ________��
��1��5H2O2+2MnO4+6H+=2Mn2++5O2��+8H2O ��2��KMnO4 ����O�� 6.02��1023
��3��2H2O2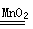 2H2O+O2��
3.01��1023
2H2O+O2��
3.01��1023
����������1�����ݵ��ӵĵ�ʧ�غ��֪��������Ӧ�ͻ�ԭ��Ӧ�ϲ���ķ���ʽΪ
5H2O2+2MnO4+6H+=2Mn2++5O2��+8H2O��
��2���������õ����ӣ�����ԭ��������ԭ��Ӧ��������������KMnO4��ʧȥ���ӣ����ϼ����ߵ��ǻ�ԭ�������Ա�������Ԫ�����������ݷ���ʽ��֪����Ԫ�صĻ��ϼ۴ӣ�1�����ߵ�0�ۣ�����1molH2O2�ڷ�Ӧ��ʧȥ2�����ӣ����ת�Ƶ�����6.02��1023��
��3��H2O2�ֽ�����������ˮ������ʽΪ2H2O2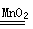 2H2O+O2�����ڷ�Ӧ��H2O2������������Ҳ�ǻ�ԭ����ת��1�����ӣ����Է�Ӧ��ת�Ƶĵ�������3.01��1023��
2H2O+O2�����ڷ�Ӧ��H2O2������������Ҳ�ǻ�ԭ����ת��1�����ӣ����Է�Ӧ��ת�Ƶĵ�������3.01��1023��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ũ���� |
| �� |
| Ũ���� |
| �� |




| ���� |
| �� |
 +��n-1��H2O
+��n-1��H2O
| ���� |
| �� |
 +��n-1��H2O
+��n-1��H2O ��
�� ��
��
 ��
�� ��
��


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�콭��ʡ�˻��а��Ÿ���ѧ����9��˫�ݼ�⻯ѧ�Ծ����������� ���ͣ������
(14��)��ϡ�����У�KMnO4��H2O2�ܷ���������ԭ��Ӧ��
������Ӧ��H2O2��2e��===2H����O2��
��ԭ��Ӧ��MnO��5e����8H��===Mn2����4H2O
(1)д����������ԭ��Ӧ�����ӷ���ʽ��______________________________________��
(2)�÷�Ӧ����������________����������Ԫ����________������0.5 mol H2O2�μӴ˷�Ӧ����ת�Ƶ��Ӹ���Ϊ________��
(3)��KMnO4�������㣬��Mn2���Ĵ������£�H2O2���ֽܷ⣬�ֽⷴӦ�Ļ�ѧ����ʽΪ__________________����ʱ����0.5 mol H2O2�����ֽ⣬��ת�Ƶ��Ӹ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�콭��ʡ�˻��а��Ÿ���ѧ����9��˫�ݼ�⻯ѧ�Ծ����������� ���ͣ������
(14��)��ϡ�����У�KMnO4��H2O2�ܷ���������ԭ��Ӧ��
������Ӧ��H2O2��2e��===2H����O2��
��ԭ��Ӧ��MnO��5e����8H��===Mn2����4H2O
(1)д����������ԭ��Ӧ�����ӷ���ʽ��______________________________________��
(2)�÷�Ӧ����������________����������Ԫ����________������0.5 mol H2O2�μӴ˷�Ӧ����ת�Ƶ��Ӹ���Ϊ________��
(3)��KMnO4�������㣬��Mn2���Ĵ������£�H2O2���ֽܷ⣬�ֽⷴӦ�Ļ�ѧ����ʽΪ__________________����ʱ����0.5 mol H2O2�����ֽ⣬��ת�Ƶ��Ӹ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011�꽭��̩����ѧ��ѧ�ڸ���������⻯ѧ�� ���ͣ������
(10��)��ҵ�ϳ��÷���м����һ��Ũ�ȵ�������Һ�Ʊ��̷�( FeSO4��7H2O )��
��1������98% 1.84 g/cm3��Ũ��������������28%��������Һ����Ũ������ˮ�������ԼΪ1�� �� ��
��2��Ϊ�ⶨij�����ڿ������̷���Ʒ��Fe2+�������ʣ�ijͬѧ�������ʵ�飺ȡһ��������Ʒ����������ϡ�����У�Ȼ�����5.00 g���۳�ַ�Ӧ���ռ���224 mL����״�������壬ʣ���������Ϊ3.88 g����÷�Ӧ�����Һ��Fe2+�����ʵ���Ϊ0.14 mol������Fe3+���������Ʒ��Fe2+���ӵ�������Ϊ �� ��
��3����������泥�(NH4)2SO4��FeSO4��6H2O��(�׳�Ī����)�����̷��ȶ�����������ԭ�ζ������г���������Fe2+�ı���Һ����ȡ0.4 g Cu2S��CuS�Ļ������������Һ����40 mL 0.150 mol/L KMnO4��Һ������������Ӧ���£�
8MnO4����5Cu2S��44H����10Cu2����5SO2��8Mn2����22H2O
6MnO4����5CuS��28H����5Cu2����5SO2��6Mn2����14H2O
��Ӧ�������Һ���Ͼ�SO2��ʣ���KMnO4ǡ����V mL 0.2 mol/L (NH4)2Fe(SO4)2��Һ��ȫ��Ӧ����֪��MnO4����Fe2����H������Mn2����Fe3+��H2O��δ��ƽ��
��V��ȡֵ��ΧΪ �� ��
����V=35���Լ���������CuS������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com