
| A. | S(s)+O2(g)═SO2(g);△H1 S(g)+O2(g)═SO2(g);△H2 | |
| B. | 2H2(g)+O2(g)═2H2O(g);△H1 2H2(g)+O2(g)═2H2O(l);△H2 | |
| C. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g);△H1 2CO(g)+O2(g)═2CO2(g);△H2 | |
| D. | H2 (g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 |
分析 A、固体硫变为气态硫需要吸收热量;
B、液态水变为气态水的过程是吸热过程;
C、CO完全燃烧放热多于不完全燃烧放的热;
D、化学反应方程式的系数加倍,焓变数值加倍.
解答 解:A、物质的燃烧反应是放热的,所以焓变是负值,固体硫变为气态硫需要吸收热量,所以△H1>△H2,故A错误;
B、物质的燃烧反应是放热的,所以焓变是负值,液态水变为气态水的过程是吸热的,故△H1>△H2,故B错误;
C、碳单质完全燃烧生成二氧化碳放热多于不完全燃烧生成一氧化碳放的热,反应的焓变是负值,故△H1>△H2,故C错误;
D、化学反应方程式的系数加倍,焓变数值加倍,该化合反应是放热的,所以焓变值是负值,2△H1=△H2,△H1<△H2,故D正确;
故选D.
点评 本题考查了物质反应能量变化分析判断,主要是盖斯定律的应用,物质量不同、状态不同、产物不同,反应的能量变化本题,题目较简单.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 3 | C. | 2 | D. | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
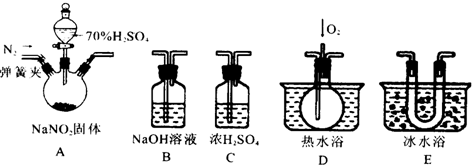
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O和18O原子的核外电子排布不相同 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | HF、HCl、HBr、HI的熔沸点逐渐升高 | |
| D. | 干冰和二氧化硅熔化时所克服微粒间的相互作用相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
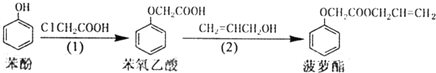
| A. | 步骤(1)、(2)的反应类型不同 | |
| B. | 步骤(1)产物中残留的苯酚能用FeCl3溶液检验 | |
| C. | 苯氧乙酸和菠萝酯均可与氢氧化钠溶液反应 | |
| D. | 步骤(2)产物中残留的烯丙醇不能用溴水检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若改变影响化学平衡的条件之一,平衡向能够使这种改变减弱的方向移动 | |
| B. | 达到化学平衡时,各组分的浓度不再改变,反应停止 | |
| C. | 化学平衡移动,化学平衡常数不一定改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):③>②>① | |
| B. | 0.2mol•L-1 CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| C. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 常温下,向0.1mol/L NH4HSO4溶液中滴加NaOH溶液至中性c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com