
(15分)氧化亚铜是大型水面舰艇防护涂层的重要原料。某小组通过查阅资料,进行如下研究。

I.Cu2O的制取
(1)葡萄糖还原法制Cu2O的化学方程式为 。
(2)实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯外,还需要 。
II.检验样品中是否含有CuO
方案1:将制得的Cu2O样品溶于足量稀硫酸。
(3)甲同学认为若溶液变为蓝色,则说明样品中含有CuO杂质。乙同学认为此推论不合理,用化学用语解释原因 。
(4)甲同学通过反思,认为将定性检验改为定量测定便能确定样品中是否含有CuO杂质,应测量的数据是 。
方案2:丙同学认为采用如下装置(所加药品均足量)进行实验,通过测定c装置反应后固体的质量以及d装置反应前后增重的质量,可计算,从而确定样品中是否含有氧化铜。

(5)装置a中所加的酸是 (填化学式),装置e中碱石灰的作用是 。
(6)点燃装置c中酒精灯之前需进行的操作是 。
(7)熄灭酒精灯之后,仍需通一段时间H2至试管冷却,原因是 。
(15分,未标分数的空每空2分,合理即给分)
(1)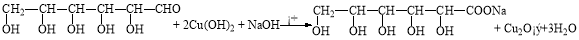
(2)漏斗、玻璃棒
(3)Cu2O + H2SO4 CuSO4+Cu + H2O
CuSO4+Cu + H2O
(4)Cu2O样品的质量、反应后剩余固体(Cu)的质量
(5)H2SO4(1分)
防止空气中的水进入d装置,m(H2O)测定不准确
(6)打开K1,关闭K2,通一段时间氢气后验纯,打开K2,关闭K1。
(7)防止生成的Cu单质在高温下又被氧气氧化为CuO,导致测定数据不准确。
【解析】
试题分析:I.(1)葡萄糖与新制氢氧化铜悬浊液加热煮沸生成葡萄糖酸钠和Cu2O沉淀,化学方程式为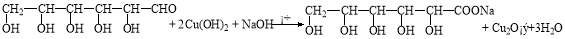 。
。
(2)实验室制取并获得少量Cu2O固体,要进行试管实验和过滤操作,需要的玻璃仪器除试管、酒精灯、烧杯外,还需要漏斗、玻璃棒。
II.(3)根据题给信息Cu2O可溶于稀盐酸、稀硫酸等,在稀硫酸溶液中歧化为二价铜和铜单质,将制得的Cu2O样品溶于足量稀硫酸溶液变为蓝色,不能说明样品中含有CuO杂质。化学方程式为Cu2O + H2SO4 CuSO4+Cu + H2O。
CuSO4+Cu + H2O。
(4)根据Cu2O + H2SO4 CuSO4+Cu + H2O通过测定Cu2O样品的质量、反应后剩余固体(Cu)的质量计算二者的物质的量,若二者物质的量相等,则样品中不含氧化铜,若二者物质的量不相等,则样品中含有氧化铜。
CuSO4+Cu + H2O通过测定Cu2O样品的质量、反应后剩余固体(Cu)的质量计算二者的物质的量,若二者物质的量相等,则样品中不含氧化铜,若二者物质的量不相等,则样品中含有氧化铜。
方案2:该实验方案的原理是用氢气还原样品,通过测定c装置反应后固体铜的质量以及d装置反应前后增重的水质量,通过计算确定样品中铜和氧的物质的量之比,从而确定样品中是否含有氧化铜。
(5)实验室制备氢气,为保证氢气纯净应使用难挥发的稀硫酸,装置a中所加的酸是H2SO4,装置e中碱石灰的作用是防止空气中的水进入d装置,m(H2O)测定不准确。
(6)为防止爆炸和装置中空气对实验结果的干扰,应先通一段时间的氢气将装置中的空气排净,点燃装置c中酒精灯之前需进行的操作是打开K1,关闭K2,通一段时间氢气后验纯,打开K2,关闭K1。
(7)熄灭酒精灯之后,仍需通一段时间H2至试管冷却,原因是防止生成的Cu单质在高温下又被氧气氧化为CuO,导致测定数据不准确。
考点:考查化学实验方案的分析、评价,物质的制备、分离和提纯。
考点分析: 考点1:物质的制备 考点2:铁及其化合物 考点3:铜及其化合物 试题属性

科目:高中化学 来源:2014-2015四川省资阳市高一上学期学期期末化学试卷(解析版) 题型:选择题
下列各组物质,按单质、化合物、混合物顺序排列的是
A.铁、干冰、冰水混合物 B.氮气、生石灰、小苏打
C.液氯、烧碱、碘酒 D.氯气、空气、漂粉精
查看答案和解析>>
科目:高中化学 来源:2014-2015上海市高一上学期期末考试化学试卷(解析版) 题型:选择题
用下列实验装置和方法进行相应实验,能达到实验目的的是

A.用图甲所示方法检查装置的气密性
B.乙图装置可用于吸收HCl气体,并防止倒吸
C.大理石和稀硫酸反应制CO2时选用丙图装置
D.用丁图所示装置将溶液定容到100mL
查看答案和解析>>
科目:高中化学 来源:2014-2015上海市高一上学期期末考试化学试卷(解析版) 题型:选择题
金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关 和
和 的说法中正确的是
的说法中正确的是
A. 和
和 原子中均含有22个中子
原子中均含有22个中子
B. 和
和 质子数相同
质子数相同
C. 和
和 质量数不同,不能互称同位素
质量数不同,不能互称同位素
D. 和
和 化学性质不同
化学性质不同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市石景山区高三一模理综化学试卷(解析版) 题型:选择题
常温下,将浓度均为0.1mol/L一元酸HA溶液和NaOH溶液等体积混合,得到混合溶液①,该混合溶液pH=9,下列说法正确的是
A.①溶液中:c(A)>c(Na+)>c(OH)>c(H+)
B.①溶液中:c(HA)+c(A)=0.1mol/L
C.常温下,0.1mol/LHA溶液的pH=1
D.0.1mol/LHA溶液中:c(HA)>c(A)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市丰台区高三一模理综化学试卷(解析版) 题型:选择题
NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。下列说法正确的是

A.O2在石墨Ⅱ附近发生氧化反应
B.该电池放电时NO3-向石墨Ⅱ电极迁移
C.石墨Ⅰ附近发生的反应:3NO2 +2e- NO+ 2NO3-
NO+ 2NO3-
D.相同条件下,放电过程中消耗的NO2和O2的体积比为4∶1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三第二次模拟理综化学试卷(解析版) 题型:填空题
(15分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)已知:① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③ 2CO(g) C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式 。
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如下左图:

①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图。
②某温度下,将2.0 mol CO2(g)和6.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如下图所示,关于温度和压强的关系判断正确的是 。

A. P3>P2,T3>T2 B. P1>P3,T1>T3
C. P2>P4,T4>T2 D. P1>P4,T2>T3
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的平衡常数的表达式为:
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下CO的平衡转化率为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期第一次月考理综化学试卷(解析版) 题型:选择题
某100mL混合酸中,HNO3物质的量浓度为0.4mol/L,H2SO4物质的量浓度为0.2mol/L。向其中加入2.56gCu粉,待充分反应后(反应前后溶液体积变化忽略不计),溶液中Cu2+物质的量浓度为
A.0.15mol/L B.0.3mol/L C.0.225mol/L D.无法计算
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省湛江市高三高考测试(一)理综化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.电解饱和食盐水能制得NaOH
B.澄清石灰水能鉴别Na2CO3和NaHCO3
C.配制溶液,定容时俯视容量瓶刻度会使溶液浓度偏低
D.铁粉中混入少量铝粉,可加入过量的氨水后过滤除去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com