
【题目】氰化钠(NaCN)是一种基本化工原料,同时也是一种剧毒物质。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠(Na2S2O8)溶液来处理,以减轻环境污染。
I.(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式是______。
Ⅱ.工业制备过硫酸钠的反应原理如下:
主反应:(NH4)2S2O8+2NaOH![]() Na2S2O8+2NH3↑+2H2O
Na2S2O8+2NH3↑+2H2O
副反应:2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
某化学小组利用上述原理在实验室制备过硫酸钠,并用过硫酸钠溶液处理含氰化钠的废水。
实验一:实验室通过如下图所示装置制备Na2S2O8。

(2)装置中盛放双氧水的仪器名称是______。
(3)装置a中反应产生的气体需要持续通入装置c的原因是______。
(4)上述装置中还需补充的实验仪器或装置有______(填字母)。
A.温度计 B.洗气瓶 C.水浴加热装置 D.环形玻璃搅拌棒
实验二:测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L。
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应。实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.0×10-3mol/L 的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为5.00mL。
(5)滴定终点的现象是______。
(6)处理后的废水是否达到排放标准?______(填“是”或“否”)。
Ⅲ.(7)常温下,含硫微粒主要存在形式,受pH影响。利用电化学原理,用惰性电极电解饱和NaHSO4溶液也可以制备过硫酸钠。已知在阳极放电的离子主要为HSO4-,则阳极反应方程式为______。
【答案】NaCN+H2O2+H2O=NH3↑+NaHCO3 分液漏斗 将产生的氨气及时排除,防止发生副反应 AC 滴入最后一滴标准硝酸银溶液,锥形瓶中溶液恰好产生黄色沉淀,且半分钟沉淀不消失 是 2HSO4--2e-=S2O82-+2H+
【解析】
(1)根据元素分析,生成的酸式盐为碳酸氢钠,使湿润的红色石蕊试纸变蓝的气体为氨气,据此书写方程式;
(2)根据仪器特点可得仪器名称;
(3)根据已知主反应产生氨气,副反应氨气为反应物,从抑制副反应发生的角度分析;
(4)根据已知可知该反应要在一定温度下进行可得;
(5)废水溶液中KI为指示剂,用标准AgNO3溶液滴定,Ag+将CN-反应完全后与I-结合为AgI黄色沉淀,为终点,可得;
(6)根据Ag+~2NaCN消耗1.0×10-3mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为5.00mL,则m(NaCN)=n(NaCN)×M(NaCN)=2n(AgNO3)×M(NaCN),再计算其浓度,与0.50mg/L比较可得;
(7)阳极由HSO4-失电子被氧化为S2O82-,据此分析。
(1)NaCN用双氧水处理后,生成的酸式盐为碳酸氢钠,使湿润的红色石蕊试纸变蓝的气体为氨气,反应方程式为NaCN+H2O2+H2O=NH3↑+NaHCO3;
(2)装置中盛放双氧水的仪器为分液漏斗;
(3)主反应产生氨气,副反应氨气为反应物,故置a中反应产生的气体需要持续通入装置c,为了将产生的氨气及时排除,防止发生副反应;
(4)由题可知,主反应的温度为55℃,因此装置中还需要温度计,为维持温度,采用水浴加热,需要水浴加热装置,所以合理选项是AC;
(5)废水溶液中KI为指示剂,用标准AgNO3溶液滴定,Ag+将CN-反应完全后与I-结合为AgI黄色沉淀,因此终点现象为:滴入最后一滴标准硝酸银溶液,锥形瓶中溶液恰好产生黄色沉淀,且半分钟沉淀不消失;
(6) 根据Ag+~2NaCN消耗1.0×10-3mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为5.00mL,则m(NaCN)=n(NaCN)×M(NaCN)=2n(AgNO3)×M(NaCN)=2×1.0×10-3mol/L×5.00×10 -3L×49g/mol=49×10 -5g,废水中氰化钠的浓度为c(NaCN)=![]() =0.49mg/L<0.5mg/L,故达到排放标准;
=0.49mg/L<0.5mg/L,故达到排放标准;
(7)阳极发生氧化反应,由HSO4-失电子被氧化为S2O82-,电极反应式为:2HSO4--2e-=S2O82-+2H+。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】1,2一二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3一氯丙烯(CH2=CHCH2Cl),反应原理为:
i .CH2 =CHCH3(g) +C12(g)CH2ClCHClCH3(g) △H1=-134kJmol-1
ii . CH2 =CHCH3(g) +C12(g)CH2= CHCH2Cl(g) +HCl(g) △H2 =-102kJmol-1
请回答下列问题:
(1)已知:CH2 =CHCH2Cl (g) + HCl ( g)CH2ClCHClCH3(g)的正反应的活化能Ea(正)为132 kJmol-1,则逆反应的活化能Ea(逆)为__________ kJmol-1 。
(2)某研究小组向密闭容器中充入一定量的C12(g)和CH2 =CHCH3 ( g),分别在 A、B两种不同催化剂作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如图1所示。
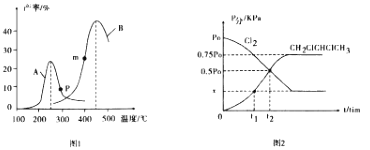
①下列说法正确的是______(填代号)。
a .使用催化剂A、B的最佳温度:A <B
b .p、m点分别是对应温度下CH2ClCHClCH3的平衡产率
c. 使用催化剂降低了反应的活化能和焓变
d. 温度不变,增大压强可使CH2ClCHClCH3的产率提高
②在250℃以后,A曲线中产率下降的原因可能是________(写出两条)。
(3)T℃时使用选择性更高的催化剂,在恒容密闭容器内充入等物质的量的C12 ( g) 和CH2=CHCH3 (g)进行反应i,测得容器各组分的分压强(p分=p总×体积分数)随时间的变化关系如图2所示,回答下列问题:
①若用单位时间内气体分压的变化来表示反应速率,即υ= ![]() ,则t1~t2时间段内平均反应速率υ(CH2=CHCH3)= _______ kPamin-1(用相关字母表示);平衡时CH2ClCHClCH3的体积分数________。
,则t1~t2时间段内平均反应速率υ(CH2=CHCH3)= _______ kPamin-1(用相关字母表示);平衡时CH2ClCHClCH3的体积分数________。
②反应的平衡常数KP=_____________(用平衡分压代替平衡浓度,相关字母表示结果)。
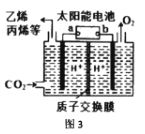
(4)如图3是在酸性电解质溶液中,用惰性电极将CO2转化为低碳烯烃的电化学装置,回答下列问题:
①太阳能电池的负极是 __________(填“a”或“b”)。
②生成丙烯的电极反应式是____________。
③相同时间内,相同条件下,消耗的CO2与生成的O2 的体积之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池在充放电过程中表现出了良好的循环稳定性,具有较长的循环寿命,放电时的反应为:LixC6+Li1-xFePO4=6C+LiFePO4-。某磷酸铁锂电池的切面如图所示。下列有关说法错误的是

A.放电时,Li+脱离石墨,该过程中碳元素化合价发生了变化
B.在周期表中,与Li的化学性质最相似的邻族元素是Mg,其基态原子核外M层的两个电子自旋状态相反
C.PO43-的水解方程式为PO43-+3H2OH3PO4+3OH-
D.石墨属于混合晶体,层与层之间存在分子间作用力,层内碳原子间存在共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、G是元素周期表中原子序数依次增大的五种元素。X元素是元素周期表中核电荷数最小的元素。Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质。ZX3气体溶于水呈碱性。W的外围电子排布是3s1。G2+离子的M层d轨道只有5个电子。请回答下列问题:
(1)W在元素周期表中的位置是 ;W和Z形成的化合物水溶液呈碱性,用离子方程式表示其原因 。
(2)Z原子的第一电离能比氧原子的 (填“大”或“小”);G的基态原子电子排布式是
(3)X与Y可形成多种化合物,其中一种化合物的分子式是X6Y6,分子中只有σ键,该分子的结构简式是 ;该化合物中Y的杂化轨道类型是 。
(4)G的最高价氧化物对应水化物的钾盐,在酸性条件下,常用于测定溶液中Fe2+的含量,该反应的离子方程式是
(5)可用YX4还原ZOx以消除其污染。已知:
YX4(g) +4ZO2(g)=4ZO(g)+YO2(g)+2X2O(g) △H=" -" 574 kJ·mol-1
YX4(g)+4ZO(g)=2Z2(g)十YO2(g) +2X2O(g) △H =" -1160" kJ·mol-1
试写出用YX4还原ZO2至Z2的热化学方程式___ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置进行实验,有关现象和解释均正确的是
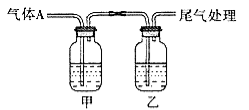
选项 | 足量A | 甲中试剂 | 乙中试剂 | 现象 | 解释 |
A | CO2 | Na2SiO3溶液 | BaCl2 | 甲浑浊、乙澄清 | 酸性:HCl>H2CO3>H2SiO3 |
B | Cl2 | 紫色石蕊 | Fe(SCN)3 | 开始均变红 | Cl2溶于水显酸性 |
C | SO2 | 品红溶液 | KMnO4 | 均褪色 | SO2具有漂白性 |
D | NH3 | AgNO3溶液 | AlCl3 | 现象相同 | NH3·H2O电离出OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个原子不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数1/5的原子和最外层电子排布式为4s24p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置正确且能达到实验目的的是
A | B | C | D | |
实验目的 | 实验室制乙酸乙酯 | 比较碳酸与苯酚酸性强弱 | 加入CCl4分离碘水中的碘 | 蒸干FeCl3溶液制无水FeCl3 |
实验装置 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列几种烃类物质:

①正四面体烷的二氯取代产物有_____种;立方烷的二氯取代产物有_____种。
② 关于苯和环辛四烯的说法正确的是_____(填字母符号)。
A 都能使酸性 KMnO4 溶液褪色
B 都能与 H2 发生加成反应,等质量的苯和环辛四烯消耗 H2 的物质的量之比为 3:4
C 都是碳碳单键和碳碳双键交替结构
D 都能发生氧化反应
(2)已知:
①R—NO2 ![]() R—NH2;
R—NH2;
②![]() +HO-SO3H
+HO-SO3H +H2O
+H2O
③苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。以下是用苯为原料制备某些化合物的转化关系图:

④A 转化为 B 的化学方程式是_____。
⑤在“ ”的所有反应中属于取代反应的是________(填字母),属于加成反应的是_____(填字母)。
”的所有反应中属于取代反应的是________(填字母),属于加成反应的是_____(填字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com