
A、 干燥Cl2 |
B、 检验K2CO3中的K+ |
C、 证明氨气极易溶于水 |
D、 实验室制氨气 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 1 |
| 50 |
| 1 |
| 50 |
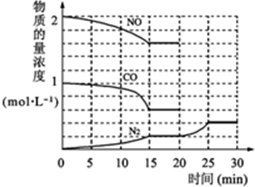
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)=0.1mol/L的甲酸溶液中,HCOO-和H+数目之和为0.1NA |
| B、标准状况下,3.36L乙烯中含有的极性键数为0.60NA |
| C、1L 0.2mol/L的Fe2(SO4)3溶液中含0.4NA个Fe3+离子 |
| D、1mol油酸含有的双键数目约为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素Z、W的简单离子的半径:Z<W |
| B、元素Y、Z分别对应的简单气态氢化物M、N,沸点M<N,热稳定性M>N |
| C、仅由X、Y、Z三种元素形成的化合物的水溶液可能呈酸性,也可能呈碱性 |
| D、1mol X2Z2与1mol W2Z2所含共价键数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3?H2O+H2O |
| B、氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+═Fe3++3H2O |
| C、能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、I-能大量共存 |
| D、已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 配置一定物质的量浓度的硫酸溶液 |
B、 检验装置的气密性 |
C、 从碘水中分离碘单质 |
D、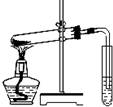 探究碳酸氢钠的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、弱碱 | B、一元强碱 |
| C、多元强碱 | D、任何强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
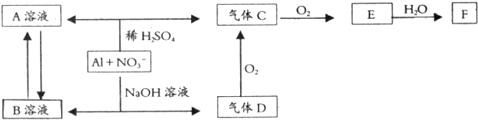
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com