
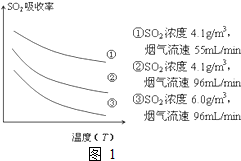
 火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
| 滴定次数 | 待测溶液 的体积/mL |
标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
- 4 |
2- 3 |
2- 4 |
- 4 |
2- 3 |
2- 4 |
| 250 |
| 25 |
| 0.63g |
| 1g |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、气体分子的数目和分子本身的大小 |
| B、气体分子的质量和分子本身的大小 |
| C、气体分子的数目和分子间的平均距离 |
| D、气体分子本身的大小和分子间的平均距离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
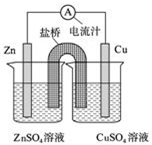
| A、原电池工作时的总反应为Zn+Cu2+═Zn2++Cu |
| B、原电池工作时,Zn电极流出电子,发生氧化反应 |
| C、若将Cu电极改为Fe电极,CuSO4溶液改为FeSO4溶液,Zn电极仍作负极 |
| D、盐桥中装有琼脂-饱和氯化钾溶液,则盐桥中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
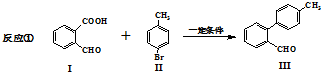
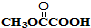 与
与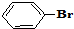 也可以发生类似反应①的反应,有机产物的结构简式为
也可以发生类似反应①的反应,有机产物的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
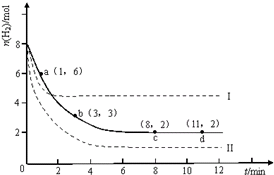 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).查看答案和解析>>
科目:高中化学 来源: 题型:
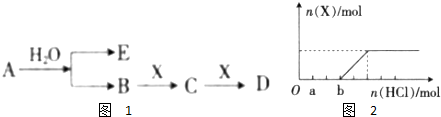
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
| A、减少O2的浓度能加快反应速率 |
| B、降低体系温度能加快反应速率 |
| C、使用催化剂不影响反应速率 |
| D、一定条件下达到反应限度时SO2部分转化为SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
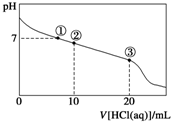 常温下,向20.00mL 0.100mol?L-1 CH3COONa溶液中逐滴加入0.1000mol?L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00mL 0.100mol?L-1 CH3COONa溶液中逐滴加入0.1000mol?L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的是( )| A、点①所示溶液中:c(CH3COOH)=c(Cl-)>c(Na+)>c(OH-)=c(H+) |
| B、点②所示溶液中:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH) |
| C、点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-) |
| D、整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com