
【题目】(1)100°C时,KW=1.0×10﹣12,在该温度下,测得0.1mol/LNa2A溶液pH=6.
①H2A在水溶液中的电离方程式为_____;
②体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,与盐酸相比,H2A溶液产生的H2____(填“多”、“少”或“一样多”).
(2)将0.4 mol/L HB溶液与0.2 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中c(Na+)>c(B-)。
①混合溶液中c(B﹣)_____c(HB)(填“>”、“<” 或“=”);
②混合溶液中c(HB)+ c(B-)_____0.2mol/L(填“>”、“<”或“=”).
(3)已知在常温下常见弱酸的电离平衡常数Ka如表所示:
溶质 | CH3COOH | H2CO3 | HClO | HCN |
电离平衡常数Ka | 1.75×10-5 | Ka1=4.4×10-7 Ka2=4.7×10-11 | 3.2×10-8 | 6.2×10-10 |
①少量二氧化碳通入NaClO溶液中的离子方程式_____;
②浓度均为0.01mol/L的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是_____(填编号);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c( CH3COO-)﹣c( CH3COOH)=___mol/L(用数值列出计算式即可).
【答案】 H2A=2H++A2﹣ 一样多 < = ClO﹣+CO2+H2O=HCO3﹣+HClO b 2(10﹣6﹣10﹣8)
【解析】(1)100°C时,KW=1.0×10﹣12,则该温度下水中c(H+)=![]() =1.0×10-6mol/L,pH=6,在该温度下,测得0.1mol/LNa2A溶液pH=6,溶液呈中性,说明Na2A是强酸强碱盐,则H2A是强酸,在水溶液中的电离方程式为:H2A=2H++A2﹣;②体积相等pH=1的盐酸与H2A溶液中氢离子的浓度相等,且均是强酸,因此分别与足量的Zn反应,产生的H2一样多;(2)将0.4mol/L HB 溶液与 0.2mol/L NaOH溶液等体积混合,则溶液中的溶质是NaB和HB,且二者物质的量浓度相等都是0.1mol/L,混合溶液中c(Na+)>c(B-),则①溶液中c(H+)<c(OH-),②溶液呈碱性,说明酸的电离程度小于酸根离子的水解程度,根据物料守恒得c(HB)+c(B-)=0.2mol/L;(3)①根据弱酸的电离平衡常数Ka可知,HClO的Ka大于H2CO3的Ka2,小于H2CO3的Ka1,故酸性强弱为H2CO3>HClO>HCO3﹣,则少量二氧化碳通入NaClO溶液中的离子方程式为:ClO﹣+CO2+H2O=HCO3﹣+HClO;②浓度相同的酸稀释相同的倍数后,酸性越强的酸其pH变化越大,HCN、HClO、CH3COOH、H2CO3四种酸的酸性大小顺序是CH3COOH>H2CO3>HClO>HCN,所以溶液的pH变化最小的是HCN,故选b;③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c(H+)=10-6mol/L,c(OH-)=10-8mol/L,根据电荷守恒有:①c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),根据物料守恒有:②2c(Na+)= c( CH3COO-)+c( CH3COOH),将①×2-②得c( CH3COO-)﹣c( CH3COOH)=2 c(H+)-2 c(OH-)=2×(10-6mol/L-10-8mol/L)=2×(10﹣6﹣10﹣8)mol/L。
=1.0×10-6mol/L,pH=6,在该温度下,测得0.1mol/LNa2A溶液pH=6,溶液呈中性,说明Na2A是强酸强碱盐,则H2A是强酸,在水溶液中的电离方程式为:H2A=2H++A2﹣;②体积相等pH=1的盐酸与H2A溶液中氢离子的浓度相等,且均是强酸,因此分别与足量的Zn反应,产生的H2一样多;(2)将0.4mol/L HB 溶液与 0.2mol/L NaOH溶液等体积混合,则溶液中的溶质是NaB和HB,且二者物质的量浓度相等都是0.1mol/L,混合溶液中c(Na+)>c(B-),则①溶液中c(H+)<c(OH-),②溶液呈碱性,说明酸的电离程度小于酸根离子的水解程度,根据物料守恒得c(HB)+c(B-)=0.2mol/L;(3)①根据弱酸的电离平衡常数Ka可知,HClO的Ka大于H2CO3的Ka2,小于H2CO3的Ka1,故酸性强弱为H2CO3>HClO>HCO3﹣,则少量二氧化碳通入NaClO溶液中的离子方程式为:ClO﹣+CO2+H2O=HCO3﹣+HClO;②浓度相同的酸稀释相同的倍数后,酸性越强的酸其pH变化越大,HCN、HClO、CH3COOH、H2CO3四种酸的酸性大小顺序是CH3COOH>H2CO3>HClO>HCN,所以溶液的pH变化最小的是HCN,故选b;③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c(H+)=10-6mol/L,c(OH-)=10-8mol/L,根据电荷守恒有:①c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),根据物料守恒有:②2c(Na+)= c( CH3COO-)+c( CH3COOH),将①×2-②得c( CH3COO-)﹣c( CH3COOH)=2 c(H+)-2 c(OH-)=2×(10-6mol/L-10-8mol/L)=2×(10﹣6﹣10﹣8)mol/L。


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为验证SO2的还原性,特邀你参与以下探究活动。
I.理论预测
该兴趣小组实验实施前进行了充分的讨论交流,确定选择SO2和FeCl3溶液的反应来探究,并预测将SO2通入FeCl3溶液中的现象。小组同学想听听你的分析,你认为可能观察到的现象是:_____________,你预测的理论依据是(用离子方程式表示):________________________。
II.实验探究
(1)配制1mol/LFeCl3溶液(未用盐酸酸化)
①下面是小组四位同学在配制溶液时的“转移”操作,其中正确的是:_______________。
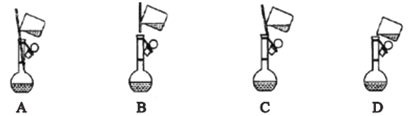
②测溶液的pH得知溶液呈酸性,其原因是:____________________ (用离子方程式表示)。
(2)SO2通入FeCl3溶液至饱和,观察到溶液由棕黄色变为红棕色,并没有观察到预期的现象。将反应后的溶液放置12小时后又出现了预期的结果。
查阅资料得知[Fe(HSO3)]2+为红棕色,生成[Fe(HSO3)]2+的反应为可逆反应。请你用化学方程式解释将SO2通入FeCl3溶液至饱和时观察到的现象:_______________。
(3)为了探究如何缩短红棕色变为预期颜色的时间,小组继续探究:另取少量FeCl3溶液,再通入SO2溶液变为红棕色,加浓HCl酸化,几分钟后变为预期颜色。
请你推测小组在实验方案设计中“加浓HC1酸化”的目的是:_______________。
III.感悟与分享
通过探究,小组同学深受启发、感悟良多。比如,有同学认为“实验才是化学的最高法庭”。请写出一种你的感悟与同学分享:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:
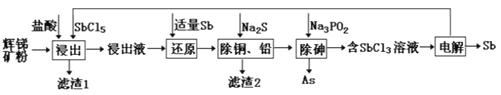
已知:①浸出液中除含过量盐酸和SbCl5之外,还含有SbCl3、PbCl2、AsCl3、CuCl2等;
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度小于等于1.0×10-5mol·L-1时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有___________(填化学式)。
(2)“浸出”时,Sb2S3发生反应的化学方程式为_______________。
(3)“还原”时,被Sb还原的物质为___________(填化学式)。
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于_________;所加Na2S也不宜过多,其原因为_____________________________。
(5)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为_________。
(6)一种突破传统电池设计理念的镁-锑液态金属储能电池工作原理如图所示:
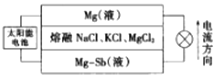
该电池由于密度的不同,在重力作用下分为三层,工作时中间层熔融盐的组成不变。充电时,Cl-向_____(填“上”或“下”)移动;放电时,负极的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1 L 0.1 mol/L的醋酸溶液用蒸馏水稀释到10 L,下列叙述正确的是( )
A. c(CH3COOH)变为原来的1/10
B. c(H+)变为原来的![]()
C. c(CH3COO-)/c(CH3COOH)的比值增大
D. 溶液的导电性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 氯水中有平衡:Cl2+H2O![]() HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
B. 对CO(g)+NO2(g)![]() CO2(g)+NO(g),平衡体系增大压强可使颜色变深
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C. 对2NO2(g)![]() N2O4(g) △H<0, 升高温度平衡体系颜色变深
N2O4(g) △H<0, 升高温度平衡体系颜色变深
D. SO2催化氧化成SO3的反应,往往加入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() (x)、
(x)、![]() (y)、
(y)、![]() (z) 互为同分异构体,下列说法不正确的是( )
(z) 互为同分异构体,下列说法不正确的是( )
A. Z的二氯代物只有三种
B. x、y、z中只有x的所有原了可能处于同一平面
C. x、y可使溴的四氯化碳溶液因发生加成反应而褪色
D. x的同分异构体只有y和z两种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com