
【题目】化学在生产和日常生活中有着重要的应用。下列说法正确的是( )
A. 相同温度下,HCN溶液的导电性比同物质的量浓度的盐酸弱可以证明HCN是弱电解质
B. 强电解质溶液稀释后,溶液中各种离子浓度一定都减小
C. 盐酸滴定氨水,可以选择酚酞为指示剂
D. 醋酸铵的水溶液显中性,所以该溶液中水的电离程度与相同条件下氯化钠溶液中水的电离程度相同
【答案】A
【解析】A. 相同温度下,HCN溶液的导电性比同物质的量浓度的盐酸弱,说明HCN的电离程度小于盐酸,可以证明HCN是弱电解质,故A正确;B. 强电解质溶液稀释后,溶液中各种离子浓度不一定都减小,如氯化钠溶液中的氢离子和氢氧根离子浓度不变,硫酸溶液中氢氧根离子浓度增大,故B错误;C. 盐酸滴定氨水,恰好完全反应时得到氯化铵溶液,氯化铵水解使溶液显酸性,而酚酞在溶液显碱性时变色,所以不可以选择酚酞为指示剂,故C错误;D. 由于![]() 与CH3COO-的水解程度相等,导致醋酸铵的水溶液显中性,因为水解促进水的电离,所以醋酸铵溶液中水的电离程度大于相同条件下氯化钠溶液中水的电离程度,故D错误。故选A。
与CH3COO-的水解程度相等,导致醋酸铵的水溶液显中性,因为水解促进水的电离,所以醋酸铵溶液中水的电离程度大于相同条件下氯化钠溶液中水的电离程度,故D错误。故选A。


科目:高中化学 来源: 题型:
【题目】某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属,保护环境。

请回答:
(1)沉淀a中含有的单质是_____________。
(2)沉淀c的化学式是___________________。
(3)溶液A与H2O2溶液在酸性条件下反应的离子方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在20.00 mL 0.10 mol·L-1CH3COOH溶液中滴入0.10 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积关系如图所示。下列说法正确的是
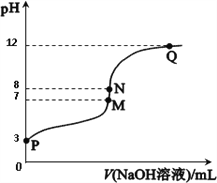
A. T℃时,CH3COOH电离平衡常数Ka=1.0×10-3
B. M点对应的NaOH溶液体积为20.0 mL
C. N点与Q点所示溶液中水的电离程度:N>Q
D. N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( ) 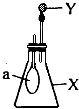
A.X是NH3 , Y是水
B.X是SO2 , Y是NaOH浓溶液
C.X是CO2 , Y是稀硫酸
D.X是HCl,Y是NaNO3稀溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水溶液一定呈中性的是( )
A. 由非电解质溶于水得到的溶液
B. [H+]、[OH–]均为5.0×10–7mol·L–1的溶液
C. 等物质的量的强酸与强碱反应得到的溶液
D. 将pH=9的烧碱溶液稀释100倍所得到的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 熵增大的反应一定是自发反应 B. 焓增大的反应一定是自发反应
C. 熵、焓都为正值的反应是自发反应 D. ΔH-TΔS<0的反应一定是自发反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使一镁铝合金粉末在过量稀H2SO4中溶解,在所得溶液中加入NaOH溶液,生成沉淀的质量w和加入NaOH溶液的体积V的关系如图所示,则该合金中镁和铝的质量之比为( ) 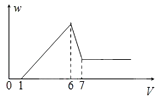
A.2:3
B.1:1
C.4:3
D.8:9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com