
【题目】根据碘与氢气反应的热化学方程式
(i)I2(g)+H2(g)![]() 2HI(g)ΔH=-9.48kJ·mol-1
2HI(g)ΔH=-9.48kJ·mol-1
(ii)I2(s)+H2(g)![]() 2HI(g)ΔH=+26.48kJ·mol-1
2HI(g)ΔH=+26.48kJ·mol-1
下列判断正确的是( )
A.254gI2(g)中通入2gH2(g),反应放热9.48kJ
B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ
C.反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定
D.反应(Ⅱ)的反应物总能量比反应(Ⅰ)的反应物总能量低
科目:高中化学 来源: 题型:
【题目】常温下,向20m1某稀Ba(OH)2溶液中滴入浓度为0.1mol/L的醋酸。溶液中由水电离出的氢氧根离子浓度随滴入醋酸的体积变化如图,下列分析正确的是

A. 稀Ba(OH)2溶液的浓度为0.1molL-1
B. C点溶液的PH=a
C. D点溶液中C(OH-)<C(H+)+C(CH2COOH)
D. E点溶液中存在C(CH2COO-)>C(Ba2+)>C(OH-)>C(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.0100mol·L-1的NaOH溶液滴入浓度为0.0100mol·L-1,体积为20.00mL的CH3COOH溶液.在滴加过程中n(CH3COOH)和n(CH3COO-)随溶液pH的分布关系如图。下列说法不正确的是( )
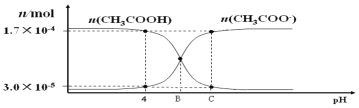
A.pH=4时,醋酸的电离常数Ka≈1.8×10-5
B.B点时,c(CH3COOˉ)=c(CH3COOH)
C.B点时,在溶液中滴入酚酞试剂,溶液显红色
D.C点时,c(CH3COOˉ)>c(Na+)>c(H+)>c(OHˉ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1mol氢气在氯气中充分燃烧生成氯化氢气体时放出184.6 kJ的热量,试写出对应的热化学方程式___________________。标准状况下11.2L氢气在氯气中充分燃烧放出的热量是______kJ。
(2)A(g)+B(g)![]() C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题。
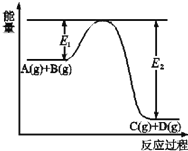
①反应物A(g)和B(g)具有的总能量_______(填大于、小于、等于)生成物C(g)和D(g)具有的总能量。
②该反应是_______反应(填吸热、放热),△H=_____(用E1和E2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
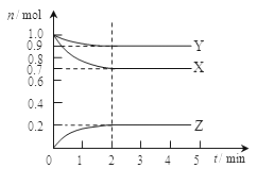
(1)该反应的化学方程式为:______________________________。
(2)反应开始至2min,用Z表示的平均反应速率为:_______________。
(3)下列叙述能说明上述反应达到化学平衡状态的是_________(填序号)。
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol X,同时生成2 mol Z
D.混合气体的总质量不随时间的变化而变化
E.恒定容积,混合气体的密度不再发生改变
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g)+ Y(g)![]() 2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)
2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)
①升高温度,反应速率_____________;
②保持容器体积不变,充入不参加反应的惰性气体,反应速率____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO![]() )=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为0.2 mol·L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的。汽车尾气脱硝脱碳的主要原理为:![]()
![]()
![]() 。一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
。一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
时间 | 0 | 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)写出该反应的平衡常数表达式_______________。
(2)前2s内的平均反应速率![]() __________;达到平衡时,CO的转化率为__________。
__________;达到平衡时,CO的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘与氢气在一定条件下反应的热化学方程式如下:
(Ⅰ)I2(g)+H2(g)![]() 2HI(g) ΔH=-9.48 kJ·mol-1
2HI(g) ΔH=-9.48 kJ·mol-1
(Ⅱ)I2(s)+H2(g)![]() 2HI(g) ΔH=+26.48 kJ·mol-1
2HI(g) ΔH=+26.48 kJ·mol-1
下列判断正确的是( )
A. 在一定条件下将2 g H2(g)通入254 g I2(g)中,该过程放出的热量为9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C. 反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定
D. 物质的量相同时,反应(Ⅰ)的反应物总能量比反应(Ⅱ)的反应物总能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜和氯化亚铜都是重要的化原料,常用作石油工业脱臭脱硫和纯化剂、印染媒染剂等。某研究小组用粗铜(含杂质Fe)为原料制备CuCl2·2H2O晶体,再用CuCl2·2H2O晶体制各CuCl。
[制备CuCl2·2H2O晶体]

(1)仪器B的名称是________________;B中反应的离子方程式为_______________________________。
(2)装置C中粗铜粉末与气体充分反应时的生成物是______________________(填化学式)。反应完成后,将C中的固体用稀盐酸完全溶解、再加入试剂M除杂,经一系列操作便可获得CuCl2·2H2O晶体。
①试剂M应当选用___________(填正确答案字母编号)
a.Cu(NO3)2 b.NaOH c.CuO d.NH3·H2O e.Cu(OH)2
②溶解C中生成物固体时,有时会加入少量双氧水,目的是____________________。
③设计简易实验方案确定所CuCl2·2H2O晶体中不含铁化合物:________________________。
[制备CuCl固体]
将CuCl2·2H2O晶体在HCl气流中加热到140℃得无水CuCl2,再加热到300℃以上可获得CuCl固体。
(3)将CuCl2·2H2O晶体在HCl气流中加热脱水的原因是__________________。
(4)为测定CuCl固体的产率,进行如下定量分析:
①将10.26gCuCl2·2H2O晶体先加热到140℃,再加热到300℃以上,充分反应后,将所得固休平均三份,分别转移至三个锥形瓶中。
②分别在三个锥形瓶中加过量FeCl3溶液不断振荡,使固体迅速溶解,再加入2滴1,10—邻菲啰啉一硫酸亚铁络合物作指示剂。
③用1.00mol/L的硫酸铈[Ce(SO4)2]标准液进行滴定。平行测定三份样品溶液,消耗硫酸铈[Ce(SO4)2]标准溶液的平均体积为19.40mL。
反应原理:CuCl+FeCl3=CuCl2+FeCl2,Fe2++Ce4+=Ce3++Fe3+
根据上述定量实验计算CuCl的产率为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com