
【题目】氯化铜和氯化亚铜都是重要的化原料,常用作石油工业脱臭脱硫和纯化剂、印染媒染剂等。某研究小组用粗铜(含杂质Fe)为原料制备CuCl2·2H2O晶体,再用CuCl2·2H2O晶体制各CuCl。
[制备CuCl2·2H2O晶体]

(1)仪器B的名称是________________;B中反应的离子方程式为_______________________________。
(2)装置C中粗铜粉末与气体充分反应时的生成物是______________________(填化学式)。反应完成后,将C中的固体用稀盐酸完全溶解、再加入试剂M除杂,经一系列操作便可获得CuCl2·2H2O晶体。
①试剂M应当选用___________(填正确答案字母编号)
a.Cu(NO3)2 b.NaOH c.CuO d.NH3·H2O e.Cu(OH)2
②溶解C中生成物固体时,有时会加入少量双氧水,目的是____________________。
③设计简易实验方案确定所CuCl2·2H2O晶体中不含铁化合物:________________________。
[制备CuCl固体]
将CuCl2·2H2O晶体在HCl气流中加热到140℃得无水CuCl2,再加热到300℃以上可获得CuCl固体。
(3)将CuCl2·2H2O晶体在HCl气流中加热脱水的原因是__________________。
(4)为测定CuCl固体的产率,进行如下定量分析:
①将10.26gCuCl2·2H2O晶体先加热到140℃,再加热到300℃以上,充分反应后,将所得固休平均三份,分别转移至三个锥形瓶中。
②分别在三个锥形瓶中加过量FeCl3溶液不断振荡,使固体迅速溶解,再加入2滴1,10—邻菲啰啉一硫酸亚铁络合物作指示剂。
③用1.00mol/L的硫酸铈[Ce(SO4)2]标准液进行滴定。平行测定三份样品溶液,消耗硫酸铈[Ce(SO4)2]标准溶液的平均体积为19.40mL。
反应原理:CuCl+FeCl3=CuCl2+FeCl2,Fe2++Ce4+=Ce3++Fe3+
根据上述定量实验计算CuCl的产率为________________________。
【答案】 圆底烧瓶或烧瓶 MnO2+4H++2C1-![]() Mn2++Cl2↑+2H2O CuCl2,FeCl3 c、e 将铁元素(或Fe2+)完全氧化成Fe3+),便于沉降分离 取少量晶体加水溶解后,滴加KSCN溶液,没有出现血红色,证明晶体不含铁化合物 防止Cu2+(或CuCl2)水解 97%或0.97
Mn2++Cl2↑+2H2O CuCl2,FeCl3 c、e 将铁元素(或Fe2+)完全氧化成Fe3+),便于沉降分离 取少量晶体加水溶解后,滴加KSCN溶液,没有出现血红色,证明晶体不含铁化合物 防止Cu2+(或CuCl2)水解 97%或0.97
【解析】试题分析:本题以氯化铜晶体和氯化亚铜的工业制备为题材,主要考查Cl2与Fe、Cl2与Cu的反应原理及制取Cl2的离子方程式的书写、离子检验方案的设计、基本实验仪器的识记,
考查考生实验分析能力、盐类水解知识的综合运用能力和化学计算的能力
解析:(1)仪器B是圆底烧瓶,其中发生的反应为:MnO2+4HCl![]() MnCl2+Cl2↑+2H2O,离子方程式为:MnO2+4H++2C1-
MnCl2+Cl2↑+2H2O,离子方程式为:MnO2+4H++2C1-![]() Mn2++Cl2↑+2H2O。正确答案:圆底烧瓶、MnO2+4H++2C1-
Mn2++Cl2↑+2H2O。正确答案:圆底烧瓶、MnO2+4H++2C1-![]() Mn2++Cl2↑+2H2O。(2)C中发生的反应为:Cu+Cl2
Mn2++Cl2↑+2H2O。(2)C中发生的反应为:Cu+Cl2 ![]() CuCl2、2Fe+3Cl2
CuCl2、2Fe+3Cl2 ![]() 2FeCl3,所以生成物是CuCl2、FeCl3,①将生成的固体溶解在稀盐酸中后,制取氯化铜晶体前需要除去FeCl3,给出的五种试剂中,a、不能除去Fe3+且会引入NO3-,b、d都会引入杂质阳离子不适合, 而c、e分别可以消耗溶液中的H+使溶液pH升高,从而使得Fe3+逐渐沉淀,所以应该选ce。②当装置C中Fe反应不充分时,Fe溶解在盐酸中生成Fe2+,在用CuO或者Cu(OH)2调节溶液pH值时不能生成沉淀除去,这样制取的氯化铜晶体就会含有杂质,所以必须先将Fe2+氧化成Fe3+。所以加入双氧水的目的是将Fe2+氧化成Fe3+,便于沉降分离。③CuCl2·2H2O晶体中可能含有的杂质是由于Fe3+沉淀不完全而混入的FeCl3,检验方法是:取少量晶体加水溶解后,滴加KSCN溶液,没有出现血红色,证明晶体不含铁化合物。正确答案:CuCl2,FeCl3、ce 、将铁元素(或Fe2+)完全氧化成Fe3+),便于沉降分离、 取少量晶体加水溶解后,滴加KSCN溶液,没有出现血红色,证明晶体不含铁化合物。(3)CuCl2·2H2O晶体直接加热脱水时,由于Cu2+水解及HCl的挥发等原因,最终得到的是CuO,所以脱水过程中必须设法避免CuCl2的水解,“在HCl气流中加热到140℃得无水CuCl2”,可以利用体系中存在的HCl抑制CuCl2水解。正确答案:防止CuCl2水解。(4)CuCl2·2H2O
2FeCl3,所以生成物是CuCl2、FeCl3,①将生成的固体溶解在稀盐酸中后,制取氯化铜晶体前需要除去FeCl3,给出的五种试剂中,a、不能除去Fe3+且会引入NO3-,b、d都会引入杂质阳离子不适合, 而c、e分别可以消耗溶液中的H+使溶液pH升高,从而使得Fe3+逐渐沉淀,所以应该选ce。②当装置C中Fe反应不充分时,Fe溶解在盐酸中生成Fe2+,在用CuO或者Cu(OH)2调节溶液pH值时不能生成沉淀除去,这样制取的氯化铜晶体就会含有杂质,所以必须先将Fe2+氧化成Fe3+。所以加入双氧水的目的是将Fe2+氧化成Fe3+,便于沉降分离。③CuCl2·2H2O晶体中可能含有的杂质是由于Fe3+沉淀不完全而混入的FeCl3,检验方法是:取少量晶体加水溶解后,滴加KSCN溶液,没有出现血红色,证明晶体不含铁化合物。正确答案:CuCl2,FeCl3、ce 、将铁元素(或Fe2+)完全氧化成Fe3+),便于沉降分离、 取少量晶体加水溶解后,滴加KSCN溶液,没有出现血红色,证明晶体不含铁化合物。(3)CuCl2·2H2O晶体直接加热脱水时,由于Cu2+水解及HCl的挥发等原因,最终得到的是CuO,所以脱水过程中必须设法避免CuCl2的水解,“在HCl气流中加热到140℃得无水CuCl2”,可以利用体系中存在的HCl抑制CuCl2水解。正确答案:防止CuCl2水解。(4)CuCl2·2H2O ![]() CuCl2+2H2O;2CuCl2
CuCl2+2H2O;2CuCl2![]() 2CuCl+Cl2,因此10.26g晶体理论上可以得到CuCl:
2CuCl+Cl2,因此10.26g晶体理论上可以得到CuCl:![]() 。测定过程中,CuCl→FeCl2→Ce(SO4)2,所以实验测得每份样品中CuCl:
。测定过程中,CuCl→FeCl2→Ce(SO4)2,所以实验测得每份样品中CuCl:![]() ,则CuCl的产率为
,则CuCl的产率为![]() 。正确答案:97%。
。正确答案:97%。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】硼、氮、镁、铝、铜等在工业生产中都有广泛的用途。
(1)Cu+基态核外电子排布式为___________。
(2)金属Mg、Al中第一电离能较大的是_________。
(3)化合物CH3COO[Cu(NH3)3·CO]中与Cu+形成配离子的配体为______(填化学式)。
(4)NH4NO3中N原子杂化轨道类型为_______。C、N、O三种元素的电负性由大到小的顺序为________,根据等电子原理,CO分子的结构式为________。
(5)1molCO(NH2)2·H2O2(过氧化尿素)中含有的σ键的数目为_________。
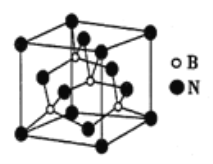
(6)氮化硼可用于制造飞机轴承,其晶胞如图所示,则处于晶胞顶点上的原子的配位数为_____,若立方氮化硼的密度为ρg/cm3,阿伏加德罗常数的值为NA,则距离最近的两个N原子之间的距离为_______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当人误食重金属盐类时,可以喝大量牛奶、蛋清或豆浆解毒。重金属盐使人中毒的原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘的提取:为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

已知步骤④中反应的化学方程式是Cl2+2KI===2KCl+I2。请填写下列空白:
(1)步骤③的实验操作名称是________。步骤⑥的实验操作名称是________。
(2)步骤⑤的操作名称是________,除烧杯外,还必须用到的玻璃仪器是________。
(3)从碘水溶液中提取碘,还可以选用下列__________(填字母)物质作为萃取剂。
a.酒精 b.苯(密度比水小) c.氯化钠溶液 d.醋酸
(4)以下关于萃取分液操作的叙述中,不正确的是______。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,如图用力振荡
![]()
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分液漏斗静置待液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗口上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物:①CH2OH(CHOH)4CHO,②CH3CH2CH2OH,③CH2===CH—CH2OH,④CH2===CH—COOCH3,⑤CH2===CH—COOH中,既能发生加成反应、酯化反应,又能发生氧化反应的是( )
A. ③⑤ B. ②④
C. ①③⑤ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最简式相同,但既不是同系物,又不是同分异构体的是
①辛烯和3-甲基-1-丁烯
②苯和乙炔
③1-氯丙烷和2—氯丙烷
④甲基环己烷和乙烯
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Al2(SO4)3溶液加热蒸干并灼烧最终得到物质是________________(填化学式),将NaHCO3与Al2(SO4)3两者溶液混合后可做泡沫灭火剂,其原理是_____________________(用离子方程式表示)
(2)实验室溶液中常用NaOH来进行洗气和提纯。当100mL 1mol·L-1的NaOH溶液吸收标准状况下2.24LSO2时,所得溶液中各离子浓度由大到小的顺序为____________________________
(3)25℃时,几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加NaOH溶液时,_____先沉淀(填离子符号),要使0.3mol·L-1硫酸铜溶液中Cu2+沉淀较为完全(当Cu2+浓度降至10-5 mol·L-1时),则应向溶液里加入氢氧化钠溶液使溶液pH为____(KspCu(OH)2=1×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL 18 mol·L-1的H2SO4溶液中加入适量的铜片并加热。充分反应后,被还原的H2SO4的物质的量( )
A. 小于0.45 mol B. 等于0.45 mol
C. 在0.45~0.90 mol之间 D. 大于0.45 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com