
【题目】硼、氮、镁、铝、铜等在工业生产中都有广泛的用途。
(1)Cu+基态核外电子排布式为___________。
(2)金属Mg、Al中第一电离能较大的是_________。
(3)化合物CH3COO[Cu(NH3)3·CO]中与Cu+形成配离子的配体为______(填化学式)。
(4)NH4NO3中N原子杂化轨道类型为_______。C、N、O三种元素的电负性由大到小的顺序为________,根据等电子原理,CO分子的结构式为________。
(5)1molCO(NH2)2·H2O2(过氧化尿素)中含有的σ键的数目为_________。
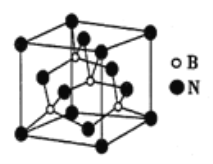
(6)氮化硼可用于制造飞机轴承,其晶胞如图所示,则处于晶胞顶点上的原子的配位数为_____,若立方氮化硼的密度为ρg/cm3,阿伏加德罗常数的值为NA,则距离最近的两个N原子之间的距离为_______cm。
【答案】 ls22s22p63s23p63dl0或[Ar] 3dl0 Mg CO和NH3 sp3和sp2 O>N>C C≡O 10NA(或6.02×l024) 4 ![]()
【解析】(1).铜原子为的核外电子排布为:ls22s22p63s23p63dl04s1,失去一个电子得到Cu+,其基态核外电子排布式为ls22s22p63s23p63dl0;
(2). Mg失去的是3s电子,Al失去的是3p电子,E3s小于E3p,p电子能量高而易失去,第一电离能Mg>Al;
(3). Cu与3个NH3和1个CO以配位键形成配离子;
(4). NO3-中N原子价层电子对个数是4、硝酸根离子中N原子价层电子对个数是3,所以N原子杂化方式为sp3杂化、sp2杂化;C、N、O三种元素为同周期,由左向右电负性增大,所以电负性O>N>C;CO与N2互为等电子体,所以CO的结构式为C≡O;
(5). CO(NH2)2H2O2中含有一个C=O,2个C-N,4个N-H,1个O-O,2个O-H,单键中含有一个σ键,双键中含有一个σ键,所以σ键的个数为10NA;
(6).面心的N原子,每个N原子连有4个B原子,所以出于晶胞顶点的N原子的配位数为4;
距离最近的N原子为面心与顶点的两个,则![]()


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
【题目】工业上以1,3-丁二烯,丙烯,乙炔等为原料合成![]() 流程图如下
流程图如下
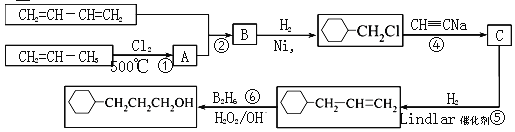
已知:有机反应中有一种双烯加成反应,如:CH2=CH—CH=CH2+CH2=CH2→ 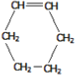 。
。
(1)反应①的反应类型是______________,B中含有的官能团的名称________________。
(2)写出反应②的化学方程式__________________________。
(3)写出C的结构简式_______________。
(4)写出![]() 含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式__________。
含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式__________。
(5)根据以上合成信息,以乙烯为原料合成1,6—己二醇,其他试剂任选,写出合成的流程图________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)![]() RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
回答下列问题:
(1)步骤D酸浸过程中发生氧化还原反应的化学方程式为______________________。
(2)萃取时应加入适量碱的作用是___________________。
(3)步骤④中反应的离子方程式为___________________。
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。所得NH4VO3为离子化合物,NH4+的电子式为_______。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为V0+,则V2O5与氢碘酸反应的离子方程式为_________________。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______mol/L(萃取的量=![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积可变的密闭容器中,反应2SO2(g)十O2(g) ![]() 2SO3(g)在一定条件下达到平衡,完成下列填空:
2SO3(g)在一定条件下达到平衡,完成下列填空:
(1)工业上该反应是在________(填设备名称)进行的,所用的催化剂是________。
(2)其他条件不变时,降低温度,平衡向正反应方向移动,则正反应为_______(选填“吸热”“放热”)。下图为反应速率(ν)与时间(t)的关系,判断在t1时刻曲线发生变化的原因是__________(选填编号)。

a.增大O2的浓度
b. 扩大容器体积
c. 加入催化剂
d. 升高温度
(3)改变条件后,平衡混合物中SO3的百分含量_______(选填“增大”“减小”“不变”)。
(4)工业上用氨水来吸收SO2尾气,最终形成化肥(NH4)2 SO4,将(NH4)2 SO4固体溶于水,溶液呈_______性,理由是____________________(用离子方程式表示),该溶液体系中存在多种守恒,请任写出其中一种守恒关系(用离子浓度表示) _______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是


① ② ③ ④
A. 装置①中,盐桥中的K+移向ZnSO4溶液
B. 装置②工作一段时间后,a极附近溶液的OH-浓度增大
C. 用装置③精炼铜时,c极为粗铜
D. 装置④中电子由Zn流向Fe,装置中有Fe2+生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】量取8.0 mL 5.0 mol·L-1 H2SO4溶液,加蒸馏水稀释至100 mL,取两份稀释后的H2SO4溶液各25 mL,分别加入等质量的Zn和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)。请计算:

(1)稀释后H2SO4溶液的物质的量浓度为________mol·L-1。
(2)加入Fe的质量至少有____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能发生的反应中,离子方程式正确的是
A. 硫酸与Ba(OH)2溶液混合:Ba2++OH-+H++SO![]() ===H2O+BaSO4↓
===H2O+BaSO4↓
B. 足量的氯气通入FeBr2溶液中:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
C. 碳酸钙和盐酸混合:CO![]() +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
D. MgCl2溶液中通入二氧化碳:Mg2++CO2+H2O===MgCO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述正确的是( )
A.所有物质里都含有化学键B.离子化合物中可能含有共价键
C.共价化合物中可能含有离子键D.水分子中的化学键是非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜和氯化亚铜都是重要的化原料,常用作石油工业脱臭脱硫和纯化剂、印染媒染剂等。某研究小组用粗铜(含杂质Fe)为原料制备CuCl2·2H2O晶体,再用CuCl2·2H2O晶体制各CuCl。
[制备CuCl2·2H2O晶体]

(1)仪器B的名称是________________;B中反应的离子方程式为_______________________________。
(2)装置C中粗铜粉末与气体充分反应时的生成物是______________________(填化学式)。反应完成后,将C中的固体用稀盐酸完全溶解、再加入试剂M除杂,经一系列操作便可获得CuCl2·2H2O晶体。
①试剂M应当选用___________(填正确答案字母编号)
a.Cu(NO3)2 b.NaOH c.CuO d.NH3·H2O e.Cu(OH)2
②溶解C中生成物固体时,有时会加入少量双氧水,目的是____________________。
③设计简易实验方案确定所CuCl2·2H2O晶体中不含铁化合物:________________________。
[制备CuCl固体]
将CuCl2·2H2O晶体在HCl气流中加热到140℃得无水CuCl2,再加热到300℃以上可获得CuCl固体。
(3)将CuCl2·2H2O晶体在HCl气流中加热脱水的原因是__________________。
(4)为测定CuCl固体的产率,进行如下定量分析:
①将10.26gCuCl2·2H2O晶体先加热到140℃,再加热到300℃以上,充分反应后,将所得固休平均三份,分别转移至三个锥形瓶中。
②分别在三个锥形瓶中加过量FeCl3溶液不断振荡,使固体迅速溶解,再加入2滴1,10—邻菲啰啉一硫酸亚铁络合物作指示剂。
③用1.00mol/L的硫酸铈[Ce(SO4)2]标准液进行滴定。平行测定三份样品溶液,消耗硫酸铈[Ce(SO4)2]标准溶液的平均体积为19.40mL。
反应原理:CuCl+FeCl3=CuCl2+FeCl2,Fe2++Ce4+=Ce3++Fe3+
根据上述定量实验计算CuCl的产率为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com