
【题目】关于下列装置说法正确的是


① ② ③ ④
A. 装置①中,盐桥中的K+移向ZnSO4溶液
B. 装置②工作一段时间后,a极附近溶液的OH-浓度增大
C. 用装置③精炼铜时,c极为粗铜
D. 装置④中电子由Zn流向Fe,装置中有Fe2+生成
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 常温常压下,11.2L氧气所含的原子数为NA
B. 1.8g的NH4+离子中含有的质子数为NA
C. 常温常压下,46gNO2含有的原子总数为3NA
D. 标况下,4.48LH2O中含有氢原子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是四种常见有机物分子的比例模型示意图。下列说法正确的是( )
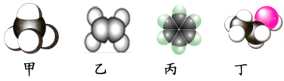
A. 甲是甲烷,甲烷能使酸性KMnO4溶液褪色
B. 乙是乙烯,乙烯可与溴水发生取代反应使溴水褪色
C. 丙是苯,苯在空气中燃烧时产生带有浓烟的火焰
D. 丁是乙酸,一定条件下乙酸能跟乙醇发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属,保护环境。
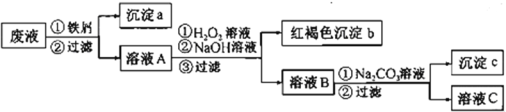
请回答:
(1)沉淀a中含有的单质是(写化学式)_______。
(2)溶液A与H2O2溶液在酸性条件下反应的离子方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、氮、镁、铝、铜等在工业生产中都有广泛的用途。
(1)Cu+基态核外电子排布式为___________。
(2)金属Mg、Al中第一电离能较大的是_________。
(3)化合物CH3COO[Cu(NH3)3·CO]中与Cu+形成配离子的配体为______(填化学式)。
(4)NH4NO3中N原子杂化轨道类型为_______。C、N、O三种元素的电负性由大到小的顺序为________,根据等电子原理,CO分子的结构式为________。
(5)1molCO(NH2)2·H2O2(过氧化尿素)中含有的σ键的数目为_________。
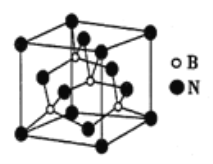
(6)氮化硼可用于制造飞机轴承,其晶胞如图所示,则处于晶胞顶点上的原子的配位数为_____,若立方氮化硼的密度为ρg/cm3,阿伏加德罗常数的值为NA,则距离最近的两个N原子之间的距离为_______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过去五年,环保部向水污染、大气污染宣战,生态环境保护取得明显成效。
Ⅰ.污水中硝酸盐浓度过高,会诱发一些水体产生亚硝胺类的致癌物质。
(1)在缺氧条件下,脱氮菌(反硝化菌)以甲醇作碳源,将NO3-还原成N2的过程如下:
反硝化作用过程:NO3-![]() NO2-
NO2-![]() NO
NO![]() N2O
N2O![]() N2
N2
阶段①会生成CO2,请写出此反应的离子方程式:__________________;阶段③生成的N2O是一种强温室气体,但却可用作火箭燃料的氧化剂,,其优点是___________________。
(2)Murphy等人通过调节溶液pH为10.25,利用铝粉将NO3-转变成N2,实现化学脱氮。
要转化0.01molNO3-,需_________gAl。
Ⅱ.CO2和CH4均为温室气体,如何减少它们的排放、充分利用能源是当今社会的重要课题。
(3)二氧化碳经催化氢化可转化成绿色能源乙醇。已知:
①2H2(g)+O2(g)=2H2O(g)△H= -483.6 kJ·mol-1
②CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1366.8kJ·mol-1
③H2O(l)=H2O(g)△H=+44.0kJ·mol-1
则二氧化碳与氢气转化成乙醇和液态水的热化学方程式为:_________。
(4)CO2和CH4在催化剂作用下可转化为合成气(CO和H2):CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) △H=+247.3kJ·mol-1。向容积为1L的密闭容器中通入反应物和生成物共5.25mol,在T℃时发生反应,气体体积分数及化学反应速率与反应时间的关系如下图所示:
2CO(g)+2H2(g) △H=+247.3kJ·mol-1。向容积为1L的密闭容器中通入反应物和生成物共5.25mol,在T℃时发生反应,气体体积分数及化学反应速率与反应时间的关系如下图所示:
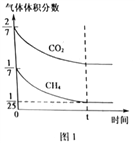
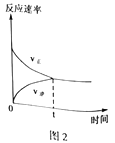
①T℃时,反应的平衡常数K=______。向平衡体系中再加入CO2、CH4、H2和CO各0.5mol,平衡将_________移动(填“向左”、“向右”或“不”)。
②写出一种既能加快化学反应速率又能提高CH4转化率的措施______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com