
【题目】过去五年,环保部向水污染、大气污染宣战,生态环境保护取得明显成效。
Ⅰ.污水中硝酸盐浓度过高,会诱发一些水体产生亚硝胺类的致癌物质。
(1)在缺氧条件下,脱氮菌(反硝化菌)以甲醇作碳源,将NO3-还原成N2的过程如下:
反硝化作用过程:NO3-![]() NO2-
NO2-![]() NO
NO![]() N2O
N2O![]() N2
N2
阶段①会生成CO2,请写出此反应的离子方程式:__________________;阶段③生成的N2O是一种强温室气体,但却可用作火箭燃料的氧化剂,,其优点是___________________。
(2)Murphy等人通过调节溶液pH为10.25,利用铝粉将NO3-转变成N2,实现化学脱氮。
要转化0.01molNO3-,需_________gAl。
Ⅱ.CO2和CH4均为温室气体,如何减少它们的排放、充分利用能源是当今社会的重要课题。
(3)二氧化碳经催化氢化可转化成绿色能源乙醇。已知:
①2H2(g)+O2(g)=2H2O(g)△H= -483.6 kJ·mol-1
②CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1366.8kJ·mol-1
③H2O(l)=H2O(g)△H=+44.0kJ·mol-1
则二氧化碳与氢气转化成乙醇和液态水的热化学方程式为:_________。
(4)CO2和CH4在催化剂作用下可转化为合成气(CO和H2):CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) △H=+247.3kJ·mol-1。向容积为1L的密闭容器中通入反应物和生成物共5.25mol,在T℃时发生反应,气体体积分数及化学反应速率与反应时间的关系如下图所示:
2CO(g)+2H2(g) △H=+247.3kJ·mol-1。向容积为1L的密闭容器中通入反应物和生成物共5.25mol,在T℃时发生反应,气体体积分数及化学反应速率与反应时间的关系如下图所示:
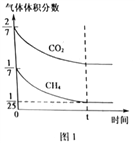
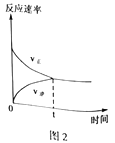
①T℃时,反应的平衡常数K=______。向平衡体系中再加入CO2、CH4、H2和CO各0.5mol,平衡将_________移动(填“向左”、“向右”或“不”)。
②写出一种既能加快化学反应速率又能提高CH4转化率的措施______________。
【答案】 3NO3-+CH3OH=3NO2-+CO2↑+2H2O 产物没有污染 0.45 2CO2(g)+6H2(g)=CH3CH2OH(l)+3H2O(l)△H=-348.0kJ·mol-1 64 向右 增大二氧化碳气体的浓度或升高温度
【解析】I.(1)本题考查氧化还原反应方程式的书写,甲醇为还原剂,被氧化成CO2,NO3-为氧化剂,被还原成NO2-,根据化合价升降法进行配平,离子反应方程式为3NO3-+CH3OH=3NO2-+CO2↑+2H2O;N2O在反应过程中,转化成N2,N2对环境无影响;(2)考查氧化还原反应的计算,0.01×5=m(Al)×3/27,解得m(Al)=0.45g;II.(3)考查热化学反应方程式的计算,CO2和H2反应方程式为2CO2+6H2→C2H6O+3H2O,因此有①×3-②-③×6得出:2CO2(g)+6H2(g)=CH3CH2OH(l)+3H2O(l)△H=-348.0kJ·mol-1;(4)本题考查化学平衡常数的计算、勒夏特列原理,①由图1和图2分析可知,起始时n(CO2)=1.5mol,n(CH4)=0.75mol,CO和H2只有一种存在且为3mol(因起始时刻v逆为0),设达到平衡时CO2转化量为xmol,
CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起始物质的量: 1.5 0.75 3(或0) 0(或3)
变化物质的量: x x 2x 2x
平衡物质的量: 1.5-x 0.75-x 3+2x(或2x) 2x(或3+2x) 达到平衡时甲烷的体积分数为1/25,因此有(0.75-x)/(5.25+2x)=1/25,解得x=0.25,根据化学平衡常数的定义,K=64,再向容器中各加入0.5mol四种气体,此时的浓度商为0.25<K,因此平衡向右进行;②根据影响化学反应速率的因素和勒夏特列原理,措施为增大CO2气体的浓度,因为正反应是放热反应,因此还可以升高温度。


科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
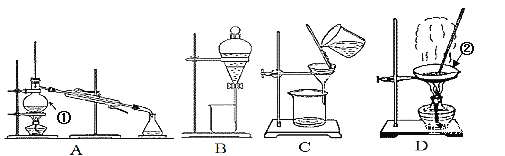
(1)装置A中仪器①的名称是______。
(2)从氯化钾溶液中得到氯化钾固体,应选择装置_____(填代表装置图的字母,下同)。
(3)分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)(已知四氯化碳和甲苯互溶),应选择装置______。
(4)从碘水中分离出I2,该装置的主要仪器名称是______,若用CCl4作为萃取剂,充分振荡后静置,观察到的现象是:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是


① ② ③ ④
A. 装置①中,盐桥中的K+移向ZnSO4溶液
B. 装置②工作一段时间后,a极附近溶液的OH-浓度增大
C. 用装置③精炼铜时,c极为粗铜
D. 装置④中电子由Zn流向Fe,装置中有Fe2+生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能发生的反应中,离子方程式正确的是
A. 硫酸与Ba(OH)2溶液混合:Ba2++OH-+H++SO![]() ===H2O+BaSO4↓
===H2O+BaSO4↓
B. 足量的氯气通入FeBr2溶液中:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
C. 碳酸钙和盐酸混合:CO![]() +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
D. MgCl2溶液中通入二氧化碳:Mg2++CO2+H2O===MgCO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟通过中和滴定实验验证某品牌陈醋的酸度。
(1)查阅资料:
①食醋组成极为复杂,除水以外的主要成分是醋酸CH3COOH,此外还有其他各种有机物和一些无机物等微量成分,醋酸的含量远远多于其他成分的含量。另外其中含一些色素成分,使食醋呈棕色(白醋除外)。
②0.1 mol·L-1醋酸与氢氧化钠恰好完全反应时的pH约为________。
A.5.6 B.7.0 C.8.8 D.13.0
③包装显示该陈醋的酸度约是3.6 g/100 mL。
(2)由以上资料,同学们认为:
①测量时可以忽略老陈醋其他成分特别是有机酸所带来的影响。
②根据陈醋的特点,只能选用________来指示滴定终点。
A.甲基橙 B.酚酞 C.石蕊
③为使滴定时溶液中的醋酸浓度接近0.1 mol·L-1,应将10 mL样品醋稀释至________。
A.36 mL B.60 mL C.360 mL D.600 mL
(3)配制标准氢氧化钠溶液
由于NaOH在称量过程中极易吸水,配好的溶液浓度往往比预期偏小。故实验小组先用0.101 0 mol·L-1的KHP标准溶液准确测定NaOH溶液的浓度(KHP与NaOH按物质的量比1∶1完全反应)。向锥形瓶中盛入20.00 mL NaOH溶液时,应用________量取。
A.20 mL的量筒 B.100 mL的容量瓶 C.碱式滴定管 D.酸式滴定管
(4)用标准氢氧化钠溶液测定醋酸的浓度,并换算为酸度。
V(NaOH) | V(KHP)平均 | ||
20.00 mL | 18.00 mL | ||
V(稀释后的醋) | V(NaOH)平均 | ||
18.00 mL | 20.00 mL | ||
计算得出该陈醋样品的酸度为________ g/100 mL。(计算结果保留4位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述正确的是( )
A.所有物质里都含有化学键B.离子化合物中可能含有共价键
C.共价化合物中可能含有离子键D.水分子中的化学键是非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]甲苯是有机化工的一种重要原料,用它制取利尿“呋塞米”和重要的化工中间体“甲基丙烯酸苄基酯”的合成路线如下(部分步骤和条件省略):
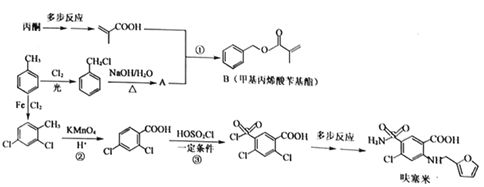
回答下列问题:
(1)A的名称为_________。
(2)反应类型:反应②_________;反应③_________。
(3)反应①的化学方程式_________。
(4)符合下列条件的B的同分异构体(不考虑立体异构)共有_________种。
①某环上只有两个取代基,且每个取代基上碳原子数不超过3个。
②与B具有相同的官能团,1mol该有机物完全水解需要消耗2molNaOH。
写出其中核磁共振氢谱只有5组峰的有机物的结构简式_________。
(5)下列说法正确的是_________。
A.呋塞米既可与强酸反应,又可与强碱反应
B.甲基丙烯酸是丙酸的同系物
C.1mol甲基丙烯酸和丙烯的混合物在氧气中完全燃烧共需要氧气4.5mol
D.可用溴水鉴甲苯和甲基丙烯酸苄基酯
(6)结合以下信息:
① ②RCN
②RCN![]() RCOOH
RCOOH
写出用丙酮和HCN为原料制备化合物![]() 的合成路线__________(其它试剂任选)。
的合成路线__________(其它试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是( )
A.在H2O2分解中加入MnO2
B.Zn与25%的稀硫酸反应制取H2时,改用98%的浓硫酸
C.在NaOH与HCL两溶液反应时,增大压强
D.Na与水反应时增大水的用量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com