
【题目】某化学兴趣小组拟通过中和滴定实验验证某品牌陈醋的酸度。
(1)查阅资料:
①食醋组成极为复杂,除水以外的主要成分是醋酸CH3COOH,此外还有其他各种有机物和一些无机物等微量成分,醋酸的含量远远多于其他成分的含量。另外其中含一些色素成分,使食醋呈棕色(白醋除外)。
②0.1 mol·L-1醋酸与氢氧化钠恰好完全反应时的pH约为________。
A.5.6 B.7.0 C.8.8 D.13.0
③包装显示该陈醋的酸度约是3.6 g/100 mL。
(2)由以上资料,同学们认为:
①测量时可以忽略老陈醋其他成分特别是有机酸所带来的影响。
②根据陈醋的特点,只能选用________来指示滴定终点。
A.甲基橙 B.酚酞 C.石蕊
③为使滴定时溶液中的醋酸浓度接近0.1 mol·L-1,应将10 mL样品醋稀释至________。
A.36 mL B.60 mL C.360 mL D.600 mL
(3)配制标准氢氧化钠溶液
由于NaOH在称量过程中极易吸水,配好的溶液浓度往往比预期偏小。故实验小组先用0.101 0 mol·L-1的KHP标准溶液准确测定NaOH溶液的浓度(KHP与NaOH按物质的量比1∶1完全反应)。向锥形瓶中盛入20.00 mL NaOH溶液时,应用________量取。
A.20 mL的量筒 B.100 mL的容量瓶 C.碱式滴定管 D.酸式滴定管
(4)用标准氢氧化钠溶液测定醋酸的浓度,并换算为酸度。
V(NaOH) | V(KHP)平均 | ||
20.00 mL | 18.00 mL | ||
V(稀释后的醋) | V(NaOH)平均 | ||
18.00 mL | 20.00 mL | ||
计算得出该陈醋样品的酸度为________ g/100 mL。(计算结果保留4位有效数字)
【答案】 C B B C 3.636
【解析】(1)醋酸与NaOH恰好反应生成醋酸钠,溶液显碱性,pH稍大于7,只有pH=8.8符合,故答案为:C;(2)②根据陈醋的特点,碱滴定酸,选择酚酞为指示剂,滴定终点时无色变为红色,答案选B;③酸度约是3.6g/100mL,浓度为 =0.6mol/L,由稀释前后溶质的物质的量不变可知,稀释后的体积为
=0.6mol/L,由稀释前后溶质的物质的量不变可知,稀释后的体积为![]() =0.06L=60mL,答案选B;(3)先用0.1010mol/L 的KHP标准溶液准确测定NaOH溶液的浓度,则NaOH盛放在锥形瓶中,选择碱式滴定管准确量取,答案选C;(4)由n(醋酸)=n(NaOH)=n(KHP)可知,c(醋酸)=
=0.06L=60mL,答案选B;(3)先用0.1010mol/L 的KHP标准溶液准确测定NaOH溶液的浓度,则NaOH盛放在锥形瓶中,选择碱式滴定管准确量取,答案选C;(4)由n(醋酸)=n(NaOH)=n(KHP)可知,c(醋酸)=![]() =0.101mol/L,该陈醋样品的酸度为3.6g/100mL×
=0.101mol/L,该陈醋样品的酸度为3.6g/100mL×![]() =3.636g/100mL。
=3.636g/100mL。


科目:高中化学 来源: 题型:
【题目】氢溴酸槟榔碱是驱除动物绦虫的有效药物,可由脂A(C4H6O2)经过如下合成路线获得:

已知:Ⅰ. 含碳碳双键的有机物与氨(NH3)或胺(RNH2)反应生成新的胺类化合物
如:R1CH=CH2 + RNH2![]() R1CH2CH2NHR
R1CH2CH2NHR
Ⅱ. R1COOR2 + R3CH2COOR4![]()
![]() + R2OH
+ R2OH
请回答:
(1)化合物E的结构简式___________________。
(2)下列说法不正确的是___________________。
A. 化合物A能发生还原反应,不能发生氧化反应
B. 化合物F能与FeCl3溶液发生显色反应
C. 化合物G具有碱性,可以生成内盐
D. 氢溴酸槟榔碱的分子式为C8H14O2NBr
(3)写出B+A→C的化学方程式___________________。
(4)写出化合物B可能的同分异构体的结构简式___________________,须同时符合:
① 分子结构中有一个六元环;
② 1H-NMR谱显示分子中有3种氢原子,IR谱显示有C-N键存在。
(5)设计酯A经路径二,通过两步反应转变为化合物E的合成路线(用流程图表示,所用试剂与路径一相同)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是 ( )
A. 2.4g金属镁所含电子数目为0.2NA B. 16g CH4所含原子数目为NA
C. 17gNH3所含质子数目为10 NA D. 18g水所含分子数目为18NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过去五年,环保部向水污染、大气污染宣战,生态环境保护取得明显成效。
Ⅰ.污水中硝酸盐浓度过高,会诱发一些水体产生亚硝胺类的致癌物质。
(1)在缺氧条件下,脱氮菌(反硝化菌)以甲醇作碳源,将NO3-还原成N2的过程如下:
反硝化作用过程:NO3-![]() NO2-
NO2-![]() NO
NO![]() N2O
N2O![]() N2
N2
阶段①会生成CO2,请写出此反应的离子方程式:__________________;阶段③生成的N2O是一种强温室气体,但却可用作火箭燃料的氧化剂,,其优点是___________________。
(2)Murphy等人通过调节溶液pH为10.25,利用铝粉将NO3-转变成N2,实现化学脱氮。
要转化0.01molNO3-,需_________gAl。
Ⅱ.CO2和CH4均为温室气体,如何减少它们的排放、充分利用能源是当今社会的重要课题。
(3)二氧化碳经催化氢化可转化成绿色能源乙醇。已知:
①2H2(g)+O2(g)=2H2O(g)△H= -483.6 kJ·mol-1
②CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1366.8kJ·mol-1
③H2O(l)=H2O(g)△H=+44.0kJ·mol-1
则二氧化碳与氢气转化成乙醇和液态水的热化学方程式为:_________。
(4)CO2和CH4在催化剂作用下可转化为合成气(CO和H2):CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) △H=+247.3kJ·mol-1。向容积为1L的密闭容器中通入反应物和生成物共5.25mol,在T℃时发生反应,气体体积分数及化学反应速率与反应时间的关系如下图所示:
2CO(g)+2H2(g) △H=+247.3kJ·mol-1。向容积为1L的密闭容器中通入反应物和生成物共5.25mol,在T℃时发生反应,气体体积分数及化学反应速率与反应时间的关系如下图所示:
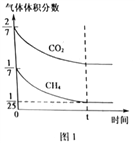
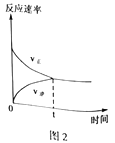
①T℃时,反应的平衡常数K=______。向平衡体系中再加入CO2、CH4、H2和CO各0.5mol,平衡将_________移动(填“向左”、“向右”或“不”)。
②写出一种既能加快化学反应速率又能提高CH4转化率的措施______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己二酸是一种重要的化工原料和合成中间体。已知:室温下,己二酸微溶于水,当温度由28℃升至78℃时,其溶解度可增大20倍。某实验小组利用绿色氧化剂H2O2氧化环己烯合成己二酸,反应和制备装置如下:
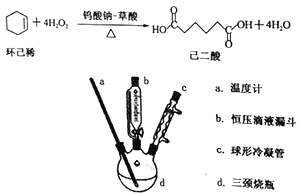
主要实验步骤:
①在100mL三颈烧瓶中依次加入1.50g钨酸钠0.57g草酸和34mL30%过氧化氢溶液,室温下磁力搅拌20min。
②用恒压滴液漏斗缓慢加入8.0mL的环己烯,继续搅拌并加热回流2小时,停止加热。
③将反应液迅速转入烧杯中,冷却至室温后再用冰水浴冷却,有大量晶体析出。抽滤,并用少量冰水洗涤,即可得到己二酸晶体粗品。
回答下列问题:
(1)本实验中使用带刻度的恒压滴液漏斗的主要作用有_________、_________。
(2)步骤③中用冰水洗涤晶体的目的是______________________________________。
己二酸晶体粗品可利用_________方法进一步获得纯品。
(3)取0.1480g己二酸(Mr=146.0)样品置于250mL锥形瓶中,加入50mL蒸馏水溶解,再加入2滴指示剂,用0.1000mol/Ld的NaOH标准溶液滴定至终点,消耗NaOH溶液的体积为20.00mL。
①本实验应选择_________(填“甲基橙”“石蕊”或“酚酞”)溶液作指示剂。
②判断滴定终点的方法是_________________________。
③样品中己二酸的质量分数为_________%(保留4位有效数字)。
(4)实验小组通过改变环己烯的用量来探究物料比对产率的影响,实验结果如下图所示。
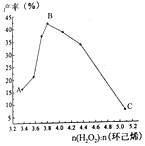
结合图像分析产率变化的可能原因:
①A点→B点:___________________________________________;
②B点→C点:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为 1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g) + H2O(g) 下列说法正确的是( )
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
II | 387 | 0.40 | ||
III | 207 | 0.20 | 0.090 | 0.090 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,容器I中的CH3OH体积分数比容器II中的小
C. 容器I中反应到达平衡所需时间比容器III的长
D. 若起始时向容器I中充入0.15mol 的CH3OH、0.15mol 的CH3OCH3和0.10mol 的H2O,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时:①HF(aq)+OH-(aq)=F-(aq)+H2O(1)ΔH=-67.7kJ·mol-1,
② H+(aq)+OH-(aq)=H2O(1) ΔH=-57.3kJ·mol-1。在20mL0.1mol·L-1氢氟酸中加入VmL0.1mol·L-1NaOH溶液,下列有关说法不正确的是( )
A. 氢氟酸的电离方程式及热效应可表示为:HF(aq)![]() F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1
F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1
B. 当V=20时,溶液中:c(OH-)=c(HF)+c(H+)
C. 当V=20时,溶液中:c(F-)<c(Na+)=0.1mol·L-1
D. 当V>0时,溶液中可能存在:c(Na+)>c(F-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com