
【题目】下列关于化学键的叙述正确的是( )
A.所有物质里都含有化学键B.离子化合物中可能含有共价键
C.共价化合物中可能含有离子键D.水分子中的化学键是非极性键
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. HNO3的摩尔质量为63g
B. 常温、常压下,32克O2含有2NA个O
C. 标准状况下,1molH2O的体积约为22.4L
D. 1L1mol/LCH3COONa溶液中c(CH3COO—)=1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、氮、镁、铝、铜等在工业生产中都有广泛的用途。
(1)Cu+基态核外电子排布式为___________。
(2)金属Mg、Al中第一电离能较大的是_________。
(3)化合物CH3COO[Cu(NH3)3·CO]中与Cu+形成配离子的配体为______(填化学式)。
(4)NH4NO3中N原子杂化轨道类型为_______。C、N、O三种元素的电负性由大到小的顺序为________,根据等电子原理,CO分子的结构式为________。
(5)1molCO(NH2)2·H2O2(过氧化尿素)中含有的σ键的数目为_________。
(6)氮化硼可用于制造飞机轴承,其晶胞如图所示,则处于晶胞顶点上的原子的配位数为_____,若立方氮化硼的密度为ρg/cm3,阿伏加德罗常数的值为NA,则距离最近的两个N原子之间的距离为_______cm。
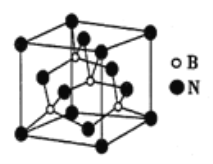
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解精炼锡后的阳极泥中除含有一定量的Sn外,还含有Ag、Bi、Cu等金属,极具回收价值。某锡冶炼厂采用纯湿法工艺从阳极泥中提取Ag、Bi、Cu,流程如下:

已知:①BiCl3+H2O![]() BiOCl+2HCl
BiOCl+2HCl
②SnO2不溶于稀酸和碱溶液
(1)锡阳极泥在“氧化浸出”前需粉碎处理,目的是__________________________。
(2)“氧化浸出"时Cu发生反应的离子方程式为______________________。
(3)浸渣1的主要成分为AgCl和SnO2,则“氨浸出“时发生反应的化学方程式为______________。
(4)水合肼(N2H4·H2O)起_________作用(填“还原”或“氧化”)。已知N2H4为二元弱碱,在水中的电离与氨相似,其第一步电离的方程式为________________________。
(5)粗银电解冶炼时用_________作阳极,用_________溶液作电解液。
(6)“沉铜铋”时应将溶液的pH调至0.5~1.0之间,目的是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过去五年,环保部向水污染、大气污染宣战,生态环境保护取得明显成效。
Ⅰ.污水中硝酸盐浓度过高,会诱发一些水体产生亚硝胺类的致癌物质。
(1)在缺氧条件下,脱氮菌(反硝化菌)以甲醇作碳源,将NO3-还原成N2的过程如下:
反硝化作用过程:NO3-![]() NO2-
NO2-![]() NO
NO![]() N2O
N2O![]() N2
N2
阶段①会生成CO2,请写出此反应的离子方程式:__________________;阶段③生成的N2O是一种强温室气体,但却可用作火箭燃料的氧化剂,,其优点是___________________。
(2)Murphy等人通过调节溶液pH为10.25,利用铝粉将NO3-转变成N2,实现化学脱氮。
要转化0.01molNO3-,需_________gAl。
Ⅱ.CO2和CH4均为温室气体,如何减少它们的排放、充分利用能源是当今社会的重要课题。
(3)二氧化碳经催化氢化可转化成绿色能源乙醇。已知:
①2H2(g)+O2(g)=2H2O(g)△H= -483.6 kJ·mol-1
②CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1366.8kJ·mol-1
③H2O(l)=H2O(g)△H=+44.0kJ·mol-1
则二氧化碳与氢气转化成乙醇和液态水的热化学方程式为:_________。
(4)CO2和CH4在催化剂作用下可转化为合成气(CO和H2):CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) △H=+247.3kJ·mol-1。向容积为1L的密闭容器中通入反应物和生成物共5.25mol,在T℃时发生反应,气体体积分数及化学反应速率与反应时间的关系如下图所示:
2CO(g)+2H2(g) △H=+247.3kJ·mol-1。向容积为1L的密闭容器中通入反应物和生成物共5.25mol,在T℃时发生反应,气体体积分数及化学反应速率与反应时间的关系如下图所示:
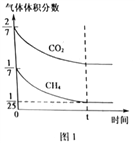
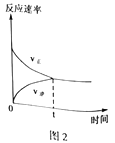
①T℃时,反应的平衡常数K=______。向平衡体系中再加入CO2、CH4、H2和CO各0.5mol,平衡将_________移动(填“向左”、“向右”或“不”)。
②写出一种既能加快化学反应速率又能提高CH4转化率的措施______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当人误食重金属盐类时,可以喝大量牛奶、蛋清或豆浆解毒。重金属盐使人中毒的原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘的提取:为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

已知步骤④中反应的化学方程式是Cl2+2KI===2KCl+I2。请填写下列空白:
(1)步骤③的实验操作名称是________。步骤⑥的实验操作名称是________。
(2)步骤⑤的操作名称是________,除烧杯外,还必须用到的玻璃仪器是________。
(3)从碘水溶液中提取碘,还可以选用下列__________(填字母)物质作为萃取剂。
a.酒精 b.苯(密度比水小) c.氯化钠溶液 d.醋酸
(4)以下关于萃取分液操作的叙述中,不正确的是______。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,如图用力振荡
![]()
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分液漏斗静置待液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗口上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Al2(SO4)3溶液加热蒸干并灼烧最终得到物质是________________(填化学式),将NaHCO3与Al2(SO4)3两者溶液混合后可做泡沫灭火剂,其原理是_____________________(用离子方程式表示)
(2)实验室溶液中常用NaOH来进行洗气和提纯。当100mL 1mol·L-1的NaOH溶液吸收标准状况下2.24LSO2时,所得溶液中各离子浓度由大到小的顺序为____________________________
(3)25℃时,几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加NaOH溶液时,_____先沉淀(填离子符号),要使0.3mol·L-1硫酸铜溶液中Cu2+沉淀较为完全(当Cu2+浓度降至10-5 mol·L-1时),则应向溶液里加入氢氧化钠溶液使溶液pH为____(KspCu(OH)2=1×10-20)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com