
【题目】下列化学用语或描述中,不正确的有
①F-的结构示意图:![]()
②氢氧根的电子式:![]()
③HClO的结构式:H—Cl—O
④SO3的水溶液能导电,说明SO3是电解质
⑤NaHSO3在水中的电离方程式:NaHSO3=Na++H++SO32-
⑥同素异形体间的转化和同位素间的转化都是化学变化
A. 1项 B. 2项 C. 5项 D. 6项
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】由铁、锌、镁、铝四种金属中的两种组成的10g混合物与足量的盐酸反应,反应后生成的氢气在标准状况下体积为11.2L.则混合物中一定含有的金属是( )
A.锌B.铁C.镁D.铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图与对应的反应情况符合的是
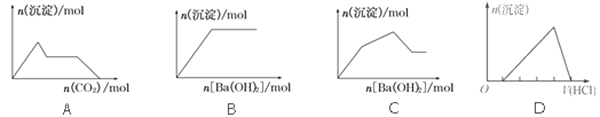
A. 向含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2至过量
B. 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
C. 向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量
D. 向含有少量氢氧化钠的NaAlO2溶液中逐滴加入盐酸至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浅绿色的硝酸亚铁溶液存在如下平衡:Fe2++2H2OFe(OH)2+2H+,若在此溶液中加入盐酸,则溶液的颜色( )
A.变深B.变浅C.变黄D.不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是( )
A. 用20mL量筒量取15mL酒精,加水5mL,配制质量分数为75%的酒精溶液(ρ<1)
B. 实验中需用2.0mol·L-1的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分数分别为950mL、201.4g
C. 在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子,同时含有NA个金属离子,则该硫酸盐的物质的量浓度为2.5mol·L-1
D. 实验室配制500mL 0.2mol·L-1的硫酸亚铁溶液,其操作是:用天平称15.2g绿矾(FeSO47H2O),放入小烧杯中加水溶解,转移到500mL容量瓶、稀释、定量、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H除外):____,所含元素的原子半径由小到大的顺序:_____,Mg在元素周期表中的位置:_______,Mg(OH)2的电子式:_____
(2)在NaCl、NaOH、N2、H2S中,只含有离子键的是____,仅含有共价键的化合物是_______
(3)用电子式表示MgCl2的形成过程___________
(4)将锌片和银片浸入稀硫酸中组成原电池,若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净,干燥后称重,总质量为47g,则产生氢气的体积___mL(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应A(g)+B(g)=C(g)+D(g),过程中的能量变化如图所示,下列说法中正确的是( )
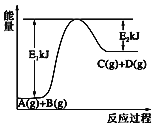
A. A的能量一定低于C
B. 反应物断键吸收的总能量大于产物新键形成放出的总能量
C. 化学反应中的能量变化都表现为热量的变化
D. 1mol气体A和1mol气体B反应生成1mol气体C和1molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H八种短周期主族元素在周期表中的相对位置如下图所示,已知C元素形成的单质有“国防金属”的美誉,E的最高价氧化物对应的水化物能与E的最简单氢化物反应生成离子化合物。
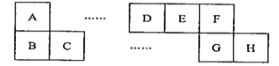
(1)D元素在周期表中的位置为______________。
(2)B、E、F的简单离子半径由大到小的顺序为______________(写离子符号)。
(3)上述元素所形成的气态单质中能用于饮用水消毒的是_________(写化学式)。
(4)F与G的氢化物中稳定的是________(写化学式)。
(5)B的单质在F的单质中燃烧所形成化合物的电子式为________。
(6)写出实验室制备E的最简单氢化物的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、容积为2L的密闭容器中通入1 mol X和2 mol Y,发生反应:X(g)+2Y(g)![]() M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
A. 0~5 min,X的平均反应速率为0.08 mol·L-1·min-1
B. 0~5 min,Y的平均反应速率为0.08 mol·L-1·min-1
C. 平衡后升高温度,X的反应速率降低
D. 到达平衡状态时,反应放出的热量为a kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com