
【题目】由铁、锌、镁、铝四种金属中的两种组成的10g混合物与足量的盐酸反应,反应后生成的氢气在标准状况下体积为11.2L.则混合物中一定含有的金属是( )
A.锌B.铁C.镁D.铝
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如图。E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同。
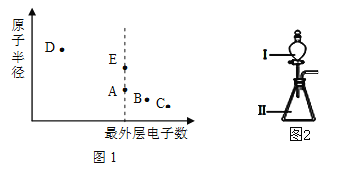
试回答:
(1)元素C在元素周期表中的位置是___________。
(2)D离子的离子结构示意图为__________。
(3)B和E最高价氧化物对应的水化物,酸性较弱的是_________。(用化学式作答)若用上如图中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ_______Ⅱ_________,观察到的实验现象是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、W 均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去, 反应可以在水溶液中进行):
![]()
Ⅰ.若A为有刺激性气味的气体,水溶液呈碱性;C 为红棕色气体,与水反应生成一元强酸D,D 具有强氧化性。
(1)在催化剂作用下,A与C反应可生成两种无污染物质,该反应化学方程式为____________。
(2)工业上常用Na2CO3溶液吸收 C,生成等物质的量的两种钠盐,该反应的离子方程式为___________。
Ⅱ.A、B、C 三种物质的溶液均显碱性,焰色反应均为黄色;C 常作面包和糕点的发泡剂,受热分解可生成B。
(3)实验室需配制 0.1 mol·L-1A溶液 450mL。根据计算用托盘天平称取 A 的质量为______g,在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_________0.1mol·L-1 (填“大于”“等于”或“小于”)。
(4)若将标准状况下2.24L的W通入150mL1mol·L-1的A溶液中,充分反应。总反应的离子方程式为_______。向两份30mL同浓度的A溶液中通入不同体积的 W 气体,得到溶液 M、N。向 M、N 溶液中逐滴加入浓度为0.2 mol·L-1盐酸,如图所示,Ⅰ和Ⅱ分别为向M、N溶液中加入盐酸的体积 V(HCl)与产生 W 气体的体积 V(W)的关系。则A溶液的物质的量浓度为____mol·L-1,M、N 两溶液中相同溶质的物质的量之比为______。
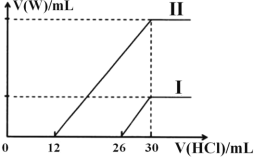
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铝热剂和铝热反应的叙述错误的是
A.铝热剂的反应原理是利用铝的强还原性
B.铝热剂不只是指铝和氧化铁混合后的物质
C.铝热反应常用于冶炼高熔点金属
D.铝热反应需用镁带和氯酸钾引燃,所以铝热反应是一个吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,c(HCN)+c(CN) =0.1 mol·L-1的一组HCN和NaCN的混合溶液,溶液中c (HCN)、c(CN-)与pH的关系如图所示。下列有关离子浓度关系叙述正确的是

A. 将0.1 mol·L-1的HCN溶液和0.1 mol·L-1NaCN溶液等体积混合(忽略溶液体积变化):c(CN-)>c(Na+)>c(HCN)>c(OH-)>c(H+)
B. W点表示溶液中:c(Na+) + c(H+) = c(HCN)
C. pH = 8的溶液中:c(Na+) + c(H+) + c(HCN) = 0.1 mol·L-1 + c(OH-)
D. 将0.3 mol·L-1 HCN溶液和0.2 mol·L-1NaOH溶液等体积混合(忽略溶液体积变化):c(CN-) + 3c(OH-) = 2c(HCN)+ 3c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题。
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为_______(写离子符号);若所得溶液c(HCO3-):c(CO32-)=2:1,溶液pH=______。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(2)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) ![]() (2CO(g)+2H2(g)
(2CO(g)+2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol-1 | 413 | 745 | 436 | 1075 |
则该反应的△H=___________。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是____________(填“A”或“B”)
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因是_______________。
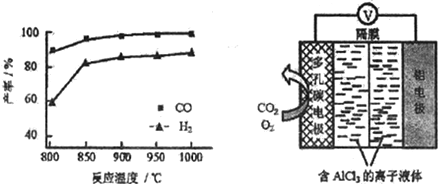
(3)O2辅助的A1-CO2电池工作原理如上图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的正极反应式:6O2+6e-=6O2- 6CO2+6O2-=3C2O42-+6O2
反应过程中O2的作用是_______________。该电池的总反应式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
![]()
![]() 【题目】实验室将9g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18g,则该氧化物粉末可能是( )
【题目】实验室将9g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18g,则该氧化物粉末可能是( )
![]()
![]() A.
A.![]() B.
B.![]() 和
和![]()
C.![]() 和
和![]() D.
D. ![]() 和FeO
和FeO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或描述中,不正确的有
①F-的结构示意图:![]()
②氢氧根的电子式:![]()
③HClO的结构式:H—Cl—O
④SO3的水溶液能导电,说明SO3是电解质
⑤NaHSO3在水中的电离方程式:NaHSO3=Na++H++SO32-
⑥同素异形体间的转化和同位素间的转化都是化学变化
A. 1项 B. 2项 C. 5项 D. 6项
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com