
【题目】298K时,在容积不变的密闭容器中注满NO2气体,2NO2(g)N2O4(g)△H<0.平衡后把该容器置于沸水中,下列性质或数值不会改变的是( )
①颜色 ②平均摩尔质量 ③质量 ④压强 ⑤密度.
A.①②
B.②③
C.④⑤
D.③⑤
【答案】D
【解析】升高温度,化学平衡向着吸热方向进行,所以化学平衡2NO2N2O4向左进行.
①二氧化氮的浓度增大,颜色加深;
②混合气体总的物质的量增大,混合气体总的质量不变,根据M= ![]() 可知,混合气体的平均相对分子质量减小;
可知,混合气体的平均相对分子质量减小;
③反应混合物都是气体,根据质量守恒定律,混合气体总的质量不变;
④升高温度,化学平衡向左移动,混合气体总的物质的量增大、混合气体的温度升高,容器的容积不变,根据pV=nRT可知,容器内压强增大;
⑤反应混合物都是气体,根据质量守恒定律,混合气体总的质量不变,容器的容积不变,根据ρ= ![]() 可知,混合气体的密度不变.
可知,混合气体的密度不变.
综上所述性质或数值不会改变的是③⑤;
故答案为:D.
该反应是一个放热反应,升高温度平衡向逆反应方向移动,分析体系中的颜色、平均摩尔质量 、质量、压强、密度等变化即可.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )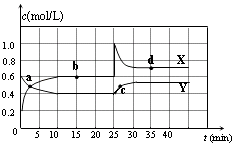
A.图中的两条曲线,X表示NO2浓度随时间的变化曲线
B.前10 min内用v(N2O4)=0.02 mol/(Lmin)
C.25 min时,NO2转变为N2O4的反应速率增大,其原 因是将密闭容器的体积缩小为1L
D.该温度下反应的平衡常数 K=1.11 L/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家凯库勒认为:苯分子是由6个碳原子以单双键相互交替结合而成的环状结构.为了验证凯库勒有关苯环的观点,甲同学设计了如图实验方案。
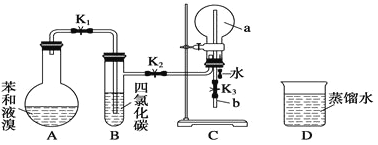
①按如图所示的装置图连接好各仪器;
②检验装置的气密性;
③在A中加入适量的苯和液溴的混合液体,再加入少最铁粉,塞上橡皮塞,打开止水夹K1、K2、K3;
④待C中烧瓶收集满气体后,将导管b的下端插入烧杯里的水中,挤压預先装有水的胶头滴管的胶头,观察实验现象。
请回答下列问题。
(1)A中所发生反应的反应方程式为_____,能证明凯库勒观点错误的实验现象是_______。
(2)装置B的作用是________。
(3)C中烧瓶的容积为500mL,收集气体时,由于空气未排尽,最终水未充满烧瓶,假设烧瓶中混合气体对H2的相对密度为37.9,则实验结束时,进入烧瓶中的水的体积为_____mL (空气的平均相对分子质量为29)。
(4)将装置A 内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯:
①用蒸馏水洗涤,振荡,分液;②用5%的NaOH 溶液洗涤,振荡,分液;③用蒸馏水洗涤,振荡,分液;④加入无水氯化钙干燥;⑤____________________ (填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关。下列叙述正确的是
A. 酯在碱性条件下的水解反应叫皂化反应![]()
B. 橡胶、合成塑料、合成纤维均是人工合成的高分子材料
C. 古代四大发明中“黑火药”的成分是“一硫二硝三木炭”,这里的“硝”指的足硝酸
D. 《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之”。“瓦”,传统无机非金属材料,主要成分为硅酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中某区域的一些元素多用于制造半导体材料,它们是
A.金属元素和非金属元素分界线附近的元素
B.右、上方区域的非金属元素
C.左、下方区域的金属元素
D.稀有气体元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取三张蓝色石蕊试纸放在玻璃片上,然后按顺序分别滴加65%的HNO3、98%的H2SO4和新制的氯水,三张试纸呈现的颜色分别是( )
A.白、红、白
B.红、黑、白
C.红、红、红
D.白、黑、白
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是5种短周期元素,原子序数依次增大。已知X组成的单质是最理想的气体燃料,Y是形成化合物种类最多的元素,Z的原子最外层电子数是次外层电子数的3倍,W、R处于同一周期,W是该周期中金属性最强的元素,W与R能形成化合物WR.
请回答下列问题:
(1)Z在周期表中的位置是_________;R的原子结构示意图是_____________。
(2)工业上用化合物WR冶炼W的单质,若要得到2.3tW,至少需要WR的质量是_____。
(3)W与Z形成的化合物W2Z2可作供氧剂,该化合物含有的化学键类型有________________,其反应原理是_______________________________(用化学方程式表示)
(4)在一定条件下,R单质能与硫反应生成一种用途广泛的硫化剂S2R2;S2R2与足量水反应有黄色沉淀生成,同时生成能使品红溶液褪色的无色气体,则该反应的化学方程式是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com