
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液。 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1 mol·L-1 KI溶液,振荡。 | 溶液无变化 |
| 然后再滴入1滴1mol·L-1的H2SO4,振荡。 | 溶液变蓝色 |


科目:高中化学 来源:不详 题型:单选题
| A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有CO32- |
| B | 向某无色溶液中滴加盐酸酸化的BaCl2 | 产生白色沉淀 | 溶液中一定含有SO42- |
| C | 将某气体通入品红溶液中 | 溶液褪色 | 该气体一定是SO2 |
| D | 将新制的Fe(OH)2露置于空气中 | 白色固体迅速变成灰绿色,最终变成红褐色 | Fe(OH)2易被氧化成Fe(OH)3 |
查看答案和解析>>
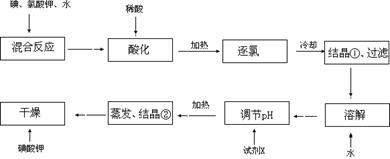
科目:高中化学 来源:不详 题型:实验题
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
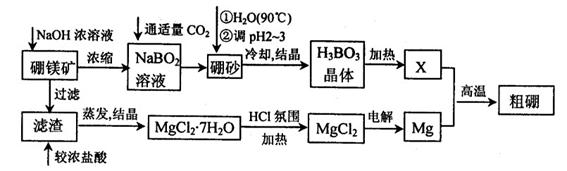
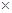 10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除去Na2CO3固体中的少量NaHCO3,置于坩埚中加热 |
| B.除去SO3中的少量SO2,可通入适量的O2 |
| C.除去合成氨中生产的NH3中的N2、H2,可采用降温的方法 |
| D.纯碱生产中所得的NH4Cl和NaHCO3混合物,可采用结晶过滤的方法分离 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.乙酸乙酯和水、乙醇和水、葡萄糖和水 |
| B.甘油和水、乙醛和水、乙酸和乙醇 |
| C.乙酸乙酯和水、溴苯和水、硝基苯和水 |
| D.乙酸和水、甲苯和水、己烷和水 |
查看答案和解析>>
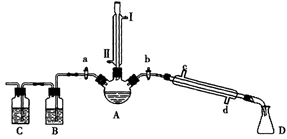
科目:高中化学 来源:不详 题型:实验题
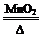 2KCl+3O2↑
2KCl+3O2↑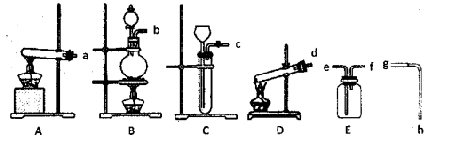
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com