
【题目】已知热化学方程式:C2H2(g)+![]() O2(g)=2CO2(g)+H2O(g)
O2(g)=2CO2(g)+H2O(g)![]() H=-1256 kJ·mol-1。下列说法正确的是( )
H=-1256 kJ·mol-1。下列说法正确的是( )
A.C2H2的燃烧热为1256kJ/mol
B.若生成2mol液态水,则![]() H=-2512kJ/mol
H=-2512kJ/mol
C.若转移10mol电子,则消耗2.5mol O2
D.若形成4mol碳氧共用电子对,则放出的热量为2512kJ
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】常温下,有浓度均为1 mol·L-1的下列4种溶液:
①H2SO4溶液 ②NaHCO3溶液 ③NH4Cl溶液 ④NaOH溶液
(1)这4种溶液pH由大到小的排列顺序是______________(填序号),其中由水电离出的H+浓度最小的是______________(填序号)。
(2)该温度下②中NaHCO3的水解平衡常数Kh=______________mol·L-1。(已知碳酸的电离常数K1=4×10-7,K2=5.6×10-11)
(3)该温度下向③中通入少量氨气,此时c(NH4+): c(NH3·H2O)的值________(填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积___④的体积(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课题式研究性学习是培养学生创造思维的良好方法。某研究性学习小组将下列装置如图连接,D、E、X、Y都是铂电极、C、F是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:

(1)B极的名称是___。
(2)甲装置中电解反应的总化学方程式是:___。
(3)设电解质溶液过量,电解后乙池中加入___(填物质名称)可以使溶液复原。
(4)设甲池中溶液的体积在电解前后都是500ml,乙池中溶液的体积在电解前后都是200mL,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为___mol/L;乙池中溶液的pH=___;
(5)装置丁中的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述,正确的是
A.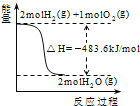 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241kJ/mol
表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241kJ/mol
B.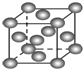 表示Cu形成金属晶体时的堆积方式
表示Cu形成金属晶体时的堆积方式
C.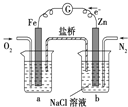 装置中烧杯a中的溶液pH降低
装置中烧杯a中的溶液pH降低
D.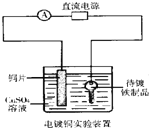 装置中待镀铁制品应与电源正极相连
装置中待镀铁制品应与电源正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(l)△H=﹣483.6 kJmol﹣1,则氢气的燃烧热为483.6 kJmol﹣1
B. 在一定温度和压强下,将0.5mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3 kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=﹣19.3kJ/mol
2NH3(g) △H=﹣19.3kJ/mol
C. 已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2 则△H1>△H2
D. 已知Ni(CO)4(s)=Ni(s)+4CO(g) △H=Q kJmol﹣1,则Ni(s)+4CO(g)=Ni(CO)4(s) △H=﹣Q kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:
C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1
根据盖斯定律,写出298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)热化学方程式:__________________________________________。
(2)在1.0 L真空密闭容器中充入4.0 mol A(g)和4.0 mol B(g),在一定温度下进行反应:A(g)+B(g)C(g) ΔH,测得不同时刻该容器内物质的物质的量如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(A)/mol | 4.0 | 2.5 | 1.5 | n2 | n3 |
n(C)/mol | 0 | 1.5 | n1 | 3 | 3 |
回答下列问题:
①随着温度的升高,该反应的化学平衡常数减小,则ΔH___(填“>”“<”或“=”)0,反应从起始到30min内A的平均反应速率是_______,该温度下,上述反应的化学平衡常数为____。
②下列选项中能说明该反应在一定温度和恒容条件下达到平衡状态的是________。
A. 反应速率:vA(正) =vC(逆) B. A的质量和C的质量相等
C. B的转化率不再改变 D. 密度不再改变
(3)若反应C(g)A(g)+B(g)进行时需加入稀释剂X气体(不参与反应),则C的平衡转化率与压强、X的物质的量的关系如图所示。
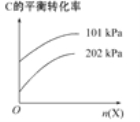
当其他条件不变时,增大X的物质的量,C的平衡转化率将________(填“增大”“减小”或“不变”),其原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
Ⅰ.室温下,现有c(H+) 相同的醋酸甲和盐酸乙:
(1)相同条件下,取等体积的甲乙两溶液,各稀释100倍。稀释后的溶液,其c(H+) 大小关系为:
甲 _____________乙 (填“大于”“小于”或“等于”,下同)。
(2)各取25 mL的甲乙两溶液,分别与等浓度的NaOH稀溶液完全反应,则消耗的NaOH溶液的体积大小关系为V(甲) _____________ V(乙)。
Ⅱ.已知25 ℃时有关弱酸的电离平衡常数如下:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
(1)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
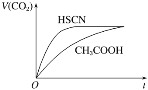
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 _____________。
(2)若保持温度不变,在醋酸溶液中通入一定量氨气,下列各量会变小的是 ______________(填字母)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
III.(1)HClO4H2SO4HCl和HNO3都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数,下列说法不正确的是 _________。
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | Ka1:6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
A.温度会影响这四种酸在冰醋中的电离常数
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4===2H++SO42-
D.这四种酸在冰醋酸中都没有完全电离,但仍属于强电解质
(2)亚磷酸是二元中强酸,25 ℃时亚磷酸(H3PO3)的电离常数为K1=1×10-2K2=2.6×10-7。
①试从电离平衡移动的角度解释K1为什么比K2大_______________________ 。
②写出亚磷酸的电离方程式(2步)_________________;_______________ 。
③请设计一种方案,使之能通过直观的实验现象判断醋酸的酸性强于H2S,该方案所用的试剂是 __________,反应的化学方程式为 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究AgCl的溶解平衡:向10 mL 1mol/L KCl 溶液中加入1 mL 0.2 mol/LAgNO3溶液,将浑浊液均分为2份,进行如下实验:
实验序号 | 实验操作 | 实验现象 |
I | 将其中一份浑浊液过滤,向滤液中放入Mg条
| i. 滤液澄清透明,用激光照射有丁达尔现象。 ii. 放入Mg条后,立即有无色气泡产生,气体可燃,滤液中出现白色浑浊。 iii. 一段时间后开始出现棕褐色浑浊物,Mg条表面也逐渐变为棕褐色,产生气泡的速率变缓慢。 |
II | 向另一份浑浊液中放入大小相同的Mg条
| iv. 棕褐色浑浊物的量明显多于实验I,Mg条表面棕褐色更深,其他现象与ii、iii相同。 |
已知:AgOH不稳定,立即分解为Ag2O(棕褐色或棕黑色),Ag粉为黑色,AgCl、Ag2O可溶于浓氨水生成Ag(NH3)2+
(1)滤液所属分散系为________。
(2)现象ii中无色气泡产生的原因是_________(写出化学方程式)。
(3)现象iii中,导致产生气泡的速率下降的主要影响因素是________。
(4)甲认为Mg条表面的棕褐色物质中一定有Ag和Ag2O,其中生成Ag的离子方程式为____。
(5)甲设计实验检验Ag:取实验I中表面变为棕褐色的Mg条于试管中,向其中加入足量试剂a,反应结束后,继续向其中加入浓硝酸,产生棕色气体,溶液中有白色不溶物。
① 白色不溶物为_____(填化学式),棕色气体产生的原因是_____(写离子方程式)。
② 试剂a为________,加入试剂a的目的是________。
③ 该实验能证明棕褐色物质中一定有Ag的实验现象是________。
(6)甲进一步设计实验验证了Mg条表面的棕褐色物质中有Ag2O,实验方案是:取实验I中表面变为棕褐色的Mg条_________。
(7)综合上述实验,能说明存在AgCl(s) ![]() Ag+(aq) + Cl-(aq)的证据及理由有________。
Ag+(aq) + Cl-(aq)的证据及理由有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.υ(A)= 0.5 mol/(L·s)B.υ(D)= 1 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s)D.υ(B)= 0.3 mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com