
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号都代表一种元素,请根据要求回答问题:
族 周期 | IA | 0 | |||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
2 | ① | ② | Ne | ||||||
3 | ③ | ④ | ⑤ | ⑥ | |||||
(1)元素①的最低价氢化物和最高价氧化物的水化物反应得到一种离子化合物的化学式为________________;
(2)②和⑥两种元素的原子半径大小关系:②________⑥(填“>”或“<”);
(3)③和⑤两种元素的金属性强弱关系:③________⑤(填“>”或“<”),它们的最高价氧化物对应水化物反应的离子方程式为__________________________________________;
(4)④的单质与⑥的最高价氧化物对应的水化物的稀溶液反应的离子方程式:________________________________。
【答案】 NH4NO3 < > OH-+Al(OH)3===AlO![]() +2H2O Mg+2H+===Mg2++H2↑
+2H2O Mg+2H+===Mg2++H2↑
【解析】根据元素在周期表中的相对位置可知①~⑥分别是N、F、Na、Mg、Al、S。则
(1)N元素的最低价氢化物氨气和最高价氧化物的水化物硝酸反应离子化合物硝酸铵,化学式为NH4NO3;(2)同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则②和⑥两种元素的原子半径大小关系:②<⑥;(3)同周期自左向右金属性逐渐减弱,则③和⑤两种元素的金属性强弱关系:③>⑤(填“>”或“<”),氢氧化铝是两性氢氧化物,它们的最高价氧化物对应水化物反应的离子方程式为 OH-+Al(OH)3=AlO![]() +2H2O;(4)④的单质与⑥的最高价氧化物对应的水化物的稀溶液稀硫酸反应的离子方程式为Mg+2H+=Mg2++H2↑。
+2H2O;(4)④的单质与⑥的最高价氧化物对应的水化物的稀溶液稀硫酸反应的离子方程式为Mg+2H+=Mg2++H2↑。


科目:高中化学 来源: 题型:
【题目】下列各组物质发生变化时,所克服的微粒间作用力属于同种类型的是( )
A.二氧化硅和氢氧化钠的熔化
B.碘和干冰的升华
C.氯化氢和氯化钠的溶解
D.汞和硫的气化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质除杂(括号内物质为杂质)所用试剂正确的是( )
物 质 | 试 剂 | |
A | Na2SO4溶液(NaBr) | Cl2 |
B | KNO3(NaCl) | AgNO3溶液 |
C | Cl2(HCl) | 饱和食盐水 |
D | CO2(HCl) | 饱和Na2CO3溶液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能检验出一定存在的离子是( )
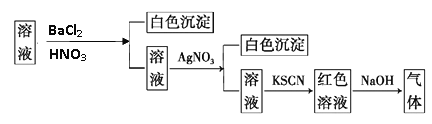
A. SO42-、NH4+ B. Cl- C. Fe3+ D. NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验操作、现象及结论均正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 取1 mL 20%的蔗糖溶液,加入3~5滴稀硫酸,水浴加热一段时间后,再滴加银氨溶液 | 没有出现银镜 | 蔗糖没有水解 |
B | 锅炉中的水垢用饱和碳酸钠溶液浸泡后,再加入稀盐酸 | 水垢明显减少 | 锅炉沉积物中的CaSO4转化为CaCO3 |
C | 常温下,在0.1 mol·L1氨水中,加入少量NH4Cl晶体 | 溶液的pH减小 | NH4Cl溶液显酸性 |
D | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | NaHCO3为难溶物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:

下列说法中正确的是
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合金的说法中错误的是
A. 铝合金中除Al外,还含有Cu、Mg、Si、Zn等
B. 生铁和钢都是铁碳合金
C. 我国在商代就已制造和使用的青铜器其成分主要是Cu-Zn合金
D. 金首饰中常加入一定量的Cu或Ag以增大硬度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的自然科学,是研究物质的性质的重要途径。某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
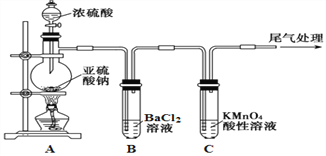
已知:Na2SO3+H2SO4(浓)![]() Na2SO4+SO2↑+H2O,请回答下列问题:
Na2SO4+SO2↑+H2O,请回答下列问题:
(1) 装置A中盛放浓硫酸的仪器名称是__________________。
(2) 实验过程中,C中的现象是____________,说明SO2具有_________性。
(3) 实验过程中,观察到装置B中出现了明显的白色沉淀。为探究该白色沉淀的成分,该小组同学进行了如下实验:
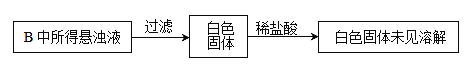
根据实验事实判断该白色沉淀的成分是_______________(填化学式),产生该白色沉淀的原因可能是_____________(填字母编号)。
a.BaSO3既不溶于水也不溶于酸
b.BaCl2溶液中可能溶解有氧气
c.BaCl2溶液中可能混有NaOH
d.由A制得的SO2气体中可能混有氧气
(4)如果将装置A中的浓H2SO4换作浓HNO3,对此实验是否有影响并说明理由_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4 ℃,熔点9.79 ℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
填写下列空白:
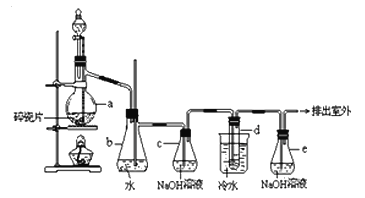
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式: 。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象: 。
(3)容器c中NaOH溶液的作用是: 。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com