
【题目】判断下列关于焓变的说法正确的是( )
A.相同条件下反应2SO2(g)+O2(g)![]() 2SO3(g)与4SO2(g)+2O2(g)
2SO3(g)与4SO2(g)+2O2(g)![]() 4SO3(g)的△H相等
4SO3(g)的△H相等
B.甲烷的标准燃烧热为-890.3kJ/mol,则甲烷燃烧的热化学方程式可以表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
C.在一定温度和压强下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放出热量19.3kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
D.一定条件2SO2(g)+O2(g)![]() 2SO3(g) △H1,2SO2(g)+O2(g)
2SO3(g) △H1,2SO2(g)+O2(g)![]() 2SO3(l) △H2,则△H1>△H2
2SO3(l) △H2,则△H1>△H2
科目:高中化学 来源: 题型:
【题目】钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的Fe3O4。某学习小组为了研究烤蓝铁片,分别进行了以下实验操作:
①把一定量烤蓝铁片加工成均匀粉末。
②取m g该粉末,放入28.00 mL 1 mol/L的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。
③再取三份不同质量的粉末,分加加到相同体积(V)、物质的量浓度均为l0.00 mol/L的三份硝酸溶液中,充分反应后,固体全部溶解,有关的实验数据如下表所示(假设NO是硝酸的唯一还原产物):
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入粉末质量/g | 13.68 | 27.36 | 34.20 |
生成气体的体积(标准状况)/L | 2.912 | 5.824 | 6.720 |
完成下列各题:
(1)实验②所得溶液中的溶质是_______(写化学式),样品中n(Fe)∶n(Fe3O4)=________,m=____________。
(2)计算实验③中每份硝酸溶液的体积(V)(mL)_________。
(3)若向实验Ⅱ所得溶液中继续加入铜粉,要使溶液中Cu2十、Fe2+、Fe3+同时存在,求加入铜粉的物质的量的范围___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学—有机化学基础)
3﹣对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下:
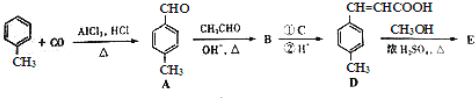
已知:HCHO+CH3CHO![]() CH2=CHCHO+H2O
CH2=CHCHO+H2O
(1)遇FeCl3溶液显紫色且苯环上有两个取代基的A的同分异构体有___________种,B中含氧官能团的名称为___________.
(2)试剂C可选用下列中的___________.
a、溴水
b、银氨溶液
c、酸性KMnO4溶液
d、新制Cu(OH)2悬浊液
(3)![]() 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为___________.
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为___________.
(4)E在一定条件下可以生成高聚物F,F的结构简式为___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一名同学把4.48 L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8 mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
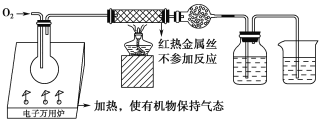
实验结束后发现无水CuSO4变蓝,干燥管和洗气瓶共增重18 g,澄清石灰水变浑浊后又恰好变澄清。请根据实验回答下列问题:
(1)O2要过量的原因是:________________。
(2)若该有机物只含C、H两种元素,且不含任何官能团,也不含脂环,则该有机物的分子式为________,它可能属于________(填序号)。
A.烷烃 B.苯的同系物 C.芳香烃 D.烃的衍生物
该物质可能的结构简式为_____________________。
(3)若该有机物分子中含有一个氧原子,则它可能是哪几类物质?请各举一例,填写在下表中:
物质种类 | 实例(写结构简式) |
_________ | _________ |
_________ | _________ |
_________ | _________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组,在实验室里模拟用N2和H2合成氨,反应的化学方程式为N2+3H2![]() 2NH3。现用未经干燥的N2和H2按体积比V(N2)∶V(H2)=1∶3充分混合后,按如图所示的装置进行有关实验。
2NH3。现用未经干燥的N2和H2按体积比V(N2)∶V(H2)=1∶3充分混合后,按如图所示的装置进行有关实验。
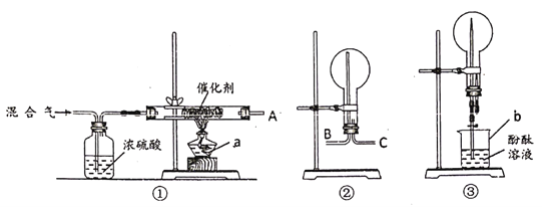
请回答下列问题:
(1)装置①中浓硫酸的作用是________。
(2)若用装置②收集反应生成的气体,A应连接装置中的________(填“B”或“C”);
(3)收集满气体后,再用装置③进行实验,当烧瓶中的液面逐渐上升,溶液呈________色。
(4)实验结束时,溶液几乎充满了烧瓶,则溶液的物质的量浓度为________mol/L(气体为标准状况下的体积)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:
![]() 。下列说法正确的是
。下列说法正确的是
A.放电时正极反应为:![]()
B.充电时阴极反应为:![]()
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.充电过程中,H+由阴极区向阳极区迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,实验结束发现试管a中的物质分为三层.对该实验的分析错误的是( )

A. 烧瓶中除发生取代反应可能发生消去反应、氧化还原反应等
B. 产物在a中第一层
C. a中有产物和水还含HBr、CH3CH2OH等
D. b中盛放的酸性KMnO4溶液会褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷有多种化合物,次磷酸(H3PO2)和次磷酸钠(NaH2PO2)常为化工生产中的还原剂。完成下列填空:
(1)H3PO2是一元中强酸,写出其电离方程式:_______;请将NaH2PO2溶液中的各离子按浓度由大到小的顺序排列:__________。
(2)室温下0.1mol/L的NaH2PO2溶液和0.1mol/L的Na2CO3溶液,pH更大的是_______,其原因是__________。
(3)化学镀银,可利用H3PO2把溶液中的Ag+还原为银的反应,已知该反应中还原剂与氧化剂的物质的量之比为1:4,则氧化产物是_______(填化学式)。
(4)工业上可用白磷(P4)与Ba(OH)2溶液反应生成PH3和Ba(H2PO2)2。写出并配平该反应的化学方程式________,若反应中转移电子6NA,用去还原剂_____mol。再向Ba(H2PO2)2溶液中加入盐酸制备H3PO2,有人说应该用硫酸代替盐酸,请说明用硫酸代替盐酸的优点:_______。
(5)下图是利用电解原理制备H3PO2的示意图(阳离子交换膜和阴离子交换膜分别只允许阳、阴离子通过;已知电极反应为:

阳极 4OH--4e→O2↑+ H2O
阴极 2H+ + 2e→H2↑):
分析在阳极室得到H3PO2原因:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 正反应的活化能比逆反应的活化能小a kJ·mol-1
D. 增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com