
����Ŀ�������й��Ȼ�ѧ����ʽ�������У���ȷ���� �� ��
A.��20.0gNaOH��ϡ��Һ��������ϡ������ȫ�кͣ��ų�28.7kJ�����������ʾ�к��ȵ��Ȼ�ѧ����ʽΪ:2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) H=-114.6kJ/mol
B.��֪�Ȼ�ѧ����ʽ�� SO2(g)+![]() O2(g)
O2(g) ![]() SO3(g) H=-98.32kJ/mol���������г���2mol SO2��1mol O2��ַ�Ӧ�����շų�������Ϊ196.64kJ
SO3(g) H=-98.32kJ/mol���������г���2mol SO2��1mol O2��ַ�Ӧ�����շų�������Ϊ196.64kJ
C.��֪2H2(g)+O2(g) =2H2O(g)H=-483.6kJ/mol����H2��ȼ����Ϊ241.8kJ/mol
D.��ϡ��ˮ��ϡ��������к��ȵIJⶨʵ�飬����õ����к��ȵ�Hƫ��
���𰸡�D
��������
A.�����к��ȵĸ����֪���к��ȵ��Ȼ�ѧ����ʽӦ��Ϊ:NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l) H=-57.3kJ/mol����A����
B. ��������Ĵ������ǿ��淴Ӧ����2mol SO2��1mol O2����һ�ܱ������з�Ӧ���ų�������С��196.64kJ����B����
C. ȼ���ȵĶ���Ϊ1mol��ȼ����ȫȼ�������ȶ�������ʱ�ų���������Ӧ������Һ̬ˮ�ſ��жϣ���C����
D.��Ϊһˮ�ϰ�ΪһԪ�������Ҫ���ȣ���������к���ƫ��D��ȷ��
�𰸣�D


 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������нṹʾ��ͼ���ж�����˵������ȷ����

A. ��NaCl�����У���Na+����Ķ��Cl-������������
B. ��CaF2�����У�Ca2+����λ��Ϊ4
C. �ڽ��ʯ�����У�̼ԭ����̼̼����֮��Ϊ1��2
D. ����̬�Ŵط��ӵķ���ʽΪEF��FE
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��20����50�����ѧ������۲���ӶԻ���ģ��(���VSEPRģ��)������Ԥ���������ṹ����Ҫ����Ը���Ϊ��
����AXnEm��ʾֻ��һ������ԭ�ӵķ�����ɣ�AΪ����ԭ�ӣ�XΪ������ԭ�����ϵ�ԭ�ӣ�EΪ����ԭ�������δ����ɼ��ĵ��Ӷ�(��Ϊ�¶Ե���)��(n��m)��Ϊ�۲���Ӷ����������еļ۲���Ӷ����ǻ����ų⣬���ȵķֲ�������ԭ����Χ�Ŀռ䣻
���ӵ����幹����ָ�����е�ԭ���ڿռ���Ų�������������ԭ��δ�ɼ��ŶԵ��ӣ�
�����м۲���Ӷ�֮��ij�����Ҫ˳��Ϊ��i���¶Ե���֮��ij������¶Ե��Ӷ��빲�õ��Ӷ�֮��ij��������õ��Ӷ�֮��ij�����ii��˫����˫��֮��ij�����˫���뵥��֮��ij����������뵥��֮��ij�����iii��Xԭ�ӵõ�������Խ����A��X�γɵĹ��õ��Ӷ�֮��ij���Խǿ��iv������������ϸ�Ķ��������ϣ��ش��������⣺
(1)����Ҫ��I���Ի���AXnEm��VSEPR����ģ�ͣ�����д�±���
n��m | 2 | ________ |
VSEPR����ģ�� | ________ | �������� |
�۲���Ӷ�֮���������� | ________ | 109��28�� |
(2)����VSEPRģ�ͽ���CO2Ϊֱ���ͷ��ӵ�ԭ��_________________________________��
(3)H2O���ӵ����幹��Ϊ��___________________������Ԥ��ˮ�����С�H��O��H�Ĵ�С��Χ������ԭ��______________________________________________________________��
(4)SO2Cl2��SO2F2����AX4E0�ͷ��ӣ�S��O֮����˫����ϣ�S��Cl��S��F֮���Ե�����ϡ�����Ԥ�� SO2Cl2��SO2F2���ӵ����幹�ͣ�_____________________________�� SO2Cl2�����С�Cl��S��Cl________________(ѡ������������������������)SO2F2�����С�F��S��F��
(5)�ü۲���ӶԻ�������(VSEPR)�ж����з��ӻ����ӵĿռ乹��
���ӻ� ���� | PbCl2 | XeF4 | SnCl62- | PF3Cl2 | HgCl42- | ClO4-- |
�ռ� ���� | _____ | _____ | _____ | _____ | _____ | _____ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����⣨![]() ��������̼��COS����������������ɱ������ش��������⣺
��������̼��COS����������������ɱ������ش��������⣺
��1����ԭ�ӵĺ�������Ų�ʽ______________��������______�ֲ�ͬ�����ĵ��ӣ����������____���˶�״̬��ͬ�ĵ��ӣ���Щ����ռ�ݵĹ����Ϊ____����
��2������̼�У�Ԫ�صķǽ�������ǿ��Ԫ�������ڱ��е�λ����______����֪COS��![]() �Ľṹ���ƣ���д��COS�ĵ���ʽ______________��COS����_____���ӣ����������������Ǽ���������
�Ľṹ���ƣ���д��COS�ĵ���ʽ______________��COS����_____���ӣ����������������Ǽ���������
����̼ˮ�⼰����Ӧ���������£����ֲ�������ȥ����
COS![]() H2S
H2S![]() Na2S
Na2S![]() M��Һ+H2
M��Һ+H2
��3��д����Ӧ������ӷ���ʽ��_____________________��
��4�����Ṥҵ�����нӴ����ڷ����ķ�Ӧ����ʽΪ___________����ʵ�������У������¶�ѡ��400~500�桢ѹǿͨ�����ó�ѹ��ԭ��ֱ���____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڴ��������£�![]() ����������NO����Ⱦ���������ֶԻ����������ʡ�д����Ӧ�Ļ�ѧ����ʽ_______���÷�Ӧ�����������뻹ԭ��������ʵ���֮����______��
����������NO����Ⱦ���������ֶԻ����������ʡ�д����Ӧ�Ļ�ѧ����ʽ_______���÷�Ӧ�����������뻹ԭ��������ʵ���֮����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йغ��������������ʵ�顣

��.ij�о���ѧϰС��������ͼװ���о���������ʡ�
ʵ��һ����ͬѧ����ͼװ����֤ʵϡ������ͭ��Ӧ����NO
��1����A����U�ι���ע��ϡ���������������___��
��2�������ռ�NO����ĸ���װ���У���������___��(����ţ���ѡ������)

��3����100mL�����Һ�У�HNO3��H2SO4�����ʵ���Ũ�ȷֱ���0.4mol/L��0.1mol/L����û��Һ�м���1.92gͭ�ۣ����ȴ���ַ�Ӧ��������Һ��Cu2�������ʵ���Ũ����__��
ʵ���������ͬѧ��������װ�����Ũ������ͭ�ķ�Ӧ
��4������ͬѧ����ʵ�������м�ƿŨ����ʻ�ɫ�����û�ѧ����ʽ�ͼ�����˵�������������� ___��
��.ijͬѧ����ͼʵ��װ��(���м�ʯ��Ϊ�����������ƺ���ʯ�ҵĻ����)��ȡ��������ش��������⣺

��5��д����ȡ�����Ļ�ѧ����ʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ã���X��Yѡ�ò�ͬ����ʱ���ɽ����ԭ���㷺Ӧ���ڹ�ҵ����������˵������ȷ����
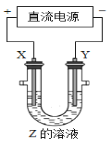
A. �ȼҵ�У�X��Y��Ϊʯī��Y�����ܵõ���������
B. ͭ�ľ����У�X�Ǵ�ͭ��Y�Ǵ�ͭ��Z��CuSO4
C. ��ƹ�ҵ�У�X�Ǵ��ƽ�����Y�ǶƲ����
D. ��ӵ����������������У�X�Ǵ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£������������Ϊ1.0 L �ĺ����ܱ������з�����Ӧ��2A(g)![]() B(g)+C(g) ��H
B(g)+C(g) ��H
���� ��� | �¶�(��) | ��ʼ���ʵ���(mol) | ƽ�����ʵ���(mol) | |
A(g) | B(g) | C(g) | ||
�� | 387 | 0. 20 | 0. 080 | 0. 080 |
�� | 387 | 0. 40 | ||
�� | 207 | 0. 20 | 0. 090 | 0. 090 |
����˵������ȷ����
A. �÷�Ӧ������ӦΪ��H<0
B. 207�棬K=4
C. �ﵽƽ��ʱ���������е�A����������������е���ͬ
D. �������з�Ӧ����ƽ������ʱ����������еĶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ڿ�����ȼ����������ף�������ˮ����Һ�ң�������Һ�еμ���ˮ����ˮ��ɫ���ұ�ɱ����ڱ������Na2S�������嶡���Ѷ�ͨ���ҵõ������졣�ס��ҡ������������������Ԫ�أ���������ȷ��˳����
A. SO3��H2SO4��H2SO3��H2S��SB. SO2��H2SO3��H2SO4��SO2��SO3
C. SO3 ��H2SO4��H2SO3��SO2��Na2S2O3D. SO2��H2SO3��H2SO4��H2S��S
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com