
����Ŀ���йغ��������������ʵ�顣

��.ij�о���ѧϰС��������ͼװ���о���������ʡ�
ʵ��һ����ͬѧ����ͼװ����֤ʵϡ������ͭ��Ӧ����NO
��1����A����U�ι���ע��ϡ���������������___��
��2�������ռ�NO����ĸ���װ���У���������___��(����ţ���ѡ������)

��3����100mL�����Һ�У�HNO3��H2SO4�����ʵ���Ũ�ȷֱ���0.4mol/L��0.1mol/L����û��Һ�м���1.92gͭ�ۣ����ȴ���ַ�Ӧ��������Һ��Cu2�������ʵ���Ũ����__��
ʵ���������ͬѧ��������װ�����Ũ������ͭ�ķ�Ӧ
��4������ͬѧ����ʵ�������м�ƿŨ����ʻ�ɫ�����û�ѧ����ʽ�ͼ�����˵�������������� ___��
��.ijͬѧ����ͼʵ��װ��(���м�ʯ��Ϊ�����������ƺ���ʯ�ҵĻ����)��ȡ��������ش��������⣺

��5��д����ȡ�����Ļ�ѧ����ʽ��___��
���𰸡�U�ι��������ɫ���������Һ������Ҹ� CE 0.225mol/L �����ֽ⣬4HNO3![]() 4NO2����O2����2H2O�����ɵ�NO2�����������У�ʹ����ʻ�ɫ 2NH4Cl��Ca(OH)2
4NO2����O2����2H2O�����ɵ�NO2�����������У�ʹ����ʻ�ɫ 2NH4Cl��Ca(OH)2![]() CaCl2��2NH3����2H2O
CaCl2��2NH3����2H2O
��������
ʵ��һ(1)ͭ��ϡ���ᷴӦ��������ͭ����ɫ����һ��������
(2)һ�������ж�����������Ӧ���ɶ���������һ����������ˮ��Ӧ�����Բ������ſ������ռ���Ӧ������ˮ���ռ���
(3)��û��Һ�м��� 1.92gͭ�ۣ���n��Cu��= ![]() =0.03mol��n��H+��=0.4mol/L��0.1L+0.1mol/L��2��0.1L=0.06mol��n��NO3-��=0.4mol/L��0.1L=0.04mol������3Cu+8H++2NO3-=3Cu2++2NO��+4H2O���жϹ������Բ�����������㣻
=0.03mol��n��H+��=0.4mol/L��0.1L+0.1mol/L��2��0.1L=0.06mol��n��NO3-��=0.4mol/L��0.1L=0.04mol������3Cu+8H++2NO3-=3Cu2++2NO��+4H2O���жϹ������Բ�����������㣻
ʵ���(4)����ȶ��ֽ�����Ķ��������ܽ����гʻ�ɫ��
(5)ʵ�������������ƺ��Ȼ���ڼ����������Ʊ��������������Ȼ��ơ�ˮ��
I��ʵ��һ(1)ͭ��ϡ���ᷴӦ��������ͭ����ɫ����һ��������U�ι��������ɫ�������������ѹǿ�����ã����Һ������Ҹߣ�
��Ϊ��U�ι��������ɫ���������Һ������Ҹߣ�
(2)һ�������ж�����������Ӧ���ɶ���������һ����������ˮ��Ӧ�����Բ������ſ������ռ���Ӧ������ˮ���ռ�����ˮװ���У�����Ľ����ڷ��ϡ��̽���������ԭ��CE��ȷ��
��ΪCE��
(3)n��Cu��=![]() =0.03mol��n��H+��=0.4mol/L��0.1L+0.1mol/L��2��0.1L=0.06mol��n��NO3-��=0.4mol/L��0.1L=0.04mol�������ķ�ӦΪ��
=0.03mol��n��H+��=0.4mol/L��0.1L+0.1mol/L��2��0.1L=0.06mol��n��NO3-��=0.4mol/L��0.1L=0.04mol�������ķ�ӦΪ��
3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO��+ 4H2O
![]()
���ݷ�����֪�������ӵ����ʵ���0.06mol<0.08mol�����H+���㣬��H+Ϊ�����㣻�������ӵ����ʵ��������ӷ���ʽ��֪0.06mol�����Ӳμӷ�Ӧ�����ɵ�ͭ���ӵ����ʵ���Ϊ0.06mol��![]() =0.0225mol��������Һ��c��Cu2+��=
=0.0225mol��������Һ��c��Cu2+��=![]() =0.225mol/L��
=0.225mol/L��
����0.225mol/L��
ʵ���(4)����ȶ��ֽ�����Ķ��������ܽ������У���Һ�ʻ�ɫ����Ӧ����ʽΪ4HNO3��Ũ��![]() 4NO2��+O2��+2H2O��
4NO2��+O2��+2H2O��
��Ϊ��4HNO3��Ũ��![]() 4NO2��+O2��+2H2O�������Ķ��������ܽ����гʻ�ɫ��
4NO2��+O2��+2H2O�������Ķ��������ܽ����гʻ�ɫ��
��.(5)ʵ�������������ƺ��Ȼ���ڼ����������Ʊ���������Ӧ����ʽΪ2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3����
CaCl2+2H2O+2NH3����
����2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3����
CaCl2+2H2O+2NH3����


 Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д�
Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д� �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Co2O3��������Һ���ױ���ԭ��Co2+��Co2O3��Cl2��FeCl3��I2�����������μ��������з�Ӧ��ˮ��Һ�в����ܷ�������( )
A.3Cl2+2FeI2=2FeCl3+2I2B.Cl2+FeI2=FeCl2+I2
C.2Fe2++ I2=2Fe3++2I-D.Co2O3+6HCl=2CoCl2+Cl2��+3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��л���˵������ȷ����(����)
A. �������ı���ϩ�;۱���ϩȼ�պ�������ͬ
B. �ı�����ϩ(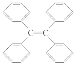 )������̼ԭ��һ������ͬһƽ��
)������̼ԭ��һ������ͬһƽ��
C. 1 mol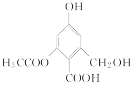 �ֱ���������Na��NaOH��Һ��NaHCO3��Һ��Ӧ���������������ʵ����ʵ����ֱ���3 mol��4 mol��1 mol
�ֱ���������Na��NaOH��Һ��NaHCO3��Һ��Ӧ���������������ʵ����ʵ����ֱ���3 mol��4 mol��1 mol
D. 1mol��������ͪ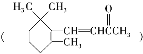 ��1molBr2�����ӳɷ�Ӧ�ɵ�3�ֲ���
��1molBr2�����ӳɷ�Ӧ�ɵ�3�ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С��̽����������泥�![]() ���ֽ�Ļ�ѧƽ���ˮ�ⷴӦ���ʡ���һ���������İ�����������ڹ̶��ݻ�Ϊ100mL���ܱ������ҺA�У��ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⡣ʵ���ò�ͬ�¶��µ�ƽ�����������±���
���ֽ�Ļ�ѧƽ���ˮ�ⷴӦ���ʡ���һ���������İ�����������ڹ̶��ݻ�Ϊ100mL���ܱ������ҺA�У��ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⡣ʵ���ò�ͬ�¶��µ�ƽ�����������±���
�¶ȣ��棩 | 20.0 | 25.0 | 30.0 | 35.0 |
ƽ�����������ʵ�����mol�� | 0.34 | 0.48 | 0.68 | 0.94 |
�ٰ�������立ֽ�Ļ�ѧ����ʽΪ![]() ����25.0��ʱ�ﵽƽ������ʱ��Ϊ8min���������ݼ���
����25.0��ʱ�ﵽƽ������ʱ��Ϊ8min���������ݼ���![]() ��ƽ����������Ϊ________________��
��ƽ����������Ϊ________________��
�ڿ����жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ�����_________��
A.2����NH3����=�ԣ�CO2���� B.�ܱ���������ѹǿ����
C. �ܱ������л��������ܶȲ��� D. �ܱ������а����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Ȼ�ѧ����ʽ�������У���ȷ���� �� ��
A.��20.0gNaOH��ϡ��Һ��������ϡ������ȫ�кͣ��ų�28.7kJ�����������ʾ�к��ȵ��Ȼ�ѧ����ʽΪ:2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) H=-114.6kJ/mol
B.��֪�Ȼ�ѧ����ʽ�� SO2(g)+![]() O2(g)
O2(g) ![]() SO3(g) H=-98.32kJ/mol���������г���2mol SO2��1mol O2��ַ�Ӧ�����շų�������Ϊ196.64kJ
SO3(g) H=-98.32kJ/mol���������г���2mol SO2��1mol O2��ַ�Ӧ�����շų�������Ϊ196.64kJ
C.��֪2H2(g)+O2(g) =2H2O(g)H=-483.6kJ/mol����H2��ȼ����Ϊ241.8kJ/mol
D.��ϡ��ˮ��ϡ��������к��ȵIJⶨʵ�飬����õ����к��ȵ�Hƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ֿɳ���-���������ͼ��ʾ������طŵ�ʱ��O2��Li+�ڶ��̼���ϵ缫������Li2O2-x��x=0��1��������˵����ȷ����

A. �ŵ�ʱ�����̼���ϵ缫Ϊ����
B. �ŵ�ʱ�����·�����ɶ��̼���ϵ缫����﮵缫
C. ���ʱ���������Һ��Li+����̼������Ǩ��
D. ���ʱ������ܷ�ӦΪLi2O2-x=2Li+��1��![]() ��O2
��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β�������������ѳ�Ϊ����������ҵ��һ����Ҫ���⣬�����ԭ����ʵ��2NO(g)��2CO(g) ![]() N2(g)��2CO2(g)�ķ�Ӧ�����ڸ÷�Ӧ������˵����ȷ���ǣ� ��
N2(g)��2CO2(g)�ķ�Ӧ�����ڸ÷�Ӧ������˵����ȷ���ǣ� ��
A. ֻҪʹ�ú����Ĵ��������壬�Ϳ���ȫ���NO��CO
B. ʹ�ô���ֻ�ܸı䷴Ӧ�����ʲ��ܸı䷴Ӧ��ƽ�ⳣ��
C. ����÷�Ӧ���ܱ������н��У�һ��ʱ���ﵽƽ��ʱc(NO)��c(CO)
D. ���º��������£�ͨ�������������NOת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������̬������Ϊ����ѧ��Ӧ������ͨ������ײ������ɵģ����Ǵӷ�Ӧ�ﵽ������Ĺ����о���һ���������Ĺ���̬����ͼ��1molNO2��1mol COǡ�÷�Ӧ����CO2��NO�����е������仯ʾ��ͼ��
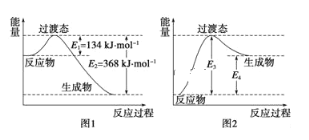
��д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ��____���÷�Ӧ�Ļ����____kJmol��1��
��ͼ��ijѧ��ģ����ͼ������NO��g��+CO2��g���TNO2��g��+CO��g���������仯ʾ��ͼ����ͼ��E3=__kJmol��1��E4=__kJmol��1��
��2�����ܱ������г���1mol H2��1mol I2��ѹǿΪp(Pa)������һ���¶���ʹ�䷢����Ӧ��H2(g)��I2(g) ![]() 2HI(g) ��H<0����������������ѹǿ���䣬�����м���1molN2����Ӧ����____����������С�����䡱����ƽ��____�ƶ����������Ӧ���������淴Ӧ����������
2HI(g) ��H<0����������������ѹǿ���䣬�����м���1molN2����Ӧ����____����������С�����䡱����ƽ��____�ƶ����������Ӧ���������淴Ӧ����������
��3��T�棬��1 L�ܱ������м���1 mol HI(g)��������Ӧ2HI![]() H2��I2��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��
H2��I2��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��
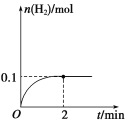
�ٸ��¶��£�2HI(g) ![]() H2(g)��I2(g)��ƽ�ⳣ��K��____��
H2(g)��I2(g)��ƽ�ⳣ��K��____��
����ͬ�¶��£�����ʼ����HI(g)�����ʵ�����ԭ����2������____��ԭ����2����
a��ƽ�ⳣ�� b��HI��ƽ��Ũ�� c���ﵽƽ���ʱ�� d��ƽ��ʱH2���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£����淴ӦA(��)+3B(��)![]() 2C(��)���ﵽƽ��ı�־��
2C(��)���ﵽƽ��ı�־��
A. C������������B�������������
B. A��B��C��Ũ�Ȳ��ٷ����仯
C. ��λʱ��������nmolA��ͬʱ����3nmolB
D. A��B��C�ķ�����֮��Ϊ1��3��2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com