
����Ŀ��ij�о�С��̽����������泥�![]() ���ֽ�Ļ�ѧƽ���ˮ�ⷴӦ���ʡ���һ���������İ�����������ڹ̶��ݻ�Ϊ100mL���ܱ������ҺA�У��ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⡣ʵ���ò�ͬ�¶��µ�ƽ�����������±���
���ֽ�Ļ�ѧƽ���ˮ�ⷴӦ���ʡ���һ���������İ�����������ڹ̶��ݻ�Ϊ100mL���ܱ������ҺA�У��ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⡣ʵ���ò�ͬ�¶��µ�ƽ�����������±���
�¶ȣ��棩 | 20.0 | 25.0 | 30.0 | 35.0 |
ƽ�����������ʵ�����mol�� | 0.34 | 0.48 | 0.68 | 0.94 |
�ٰ�������立ֽ�Ļ�ѧ����ʽΪ![]() ����25.0��ʱ�ﵽƽ������ʱ��Ϊ8min���������ݼ���
����25.0��ʱ�ﵽƽ������ʱ��Ϊ8min���������ݼ���![]() ��ƽ����������Ϊ________________��
��ƽ����������Ϊ________________��
�ڿ����жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ�����_________��
A.2����NH3����=�ԣ�CO2���� B.�ܱ���������ѹǿ����
C. �ܱ������л��������ܶȲ��� D. �ܱ������а����������������
���𰸡�0.4mol/(Lmin) BC
��������
(1)�ٻ�ѧ��Ӧ������=![]() ��
��
�ڴﵽ��ѧƽ��ʱ�����淴Ӧ������ͬ�������Ũ�ȱ��ֲ��估�������ĸ��ֹ�ϵ����ƽ���־��
���ɱ������ݿ�֪ƽ��ʱ����������ʵ���Ϊ0.48mol���������ʵ���Ϊ0.48mol��![]() =0.32mol����ѧ��Ӧ������(NH3)=
=0.32mol����ѧ��Ӧ������(NH3)= �T0.4mol/(Lmin)��
�T0.4mol/(Lmin)��
��A��NH3��CO2��ʾ�������淴Ӧ���ʱȲ����ڻ�ѧ������֮�ȣ�����˵����Ӧ�ﵽƽ��״̬��
B���÷�Ӧ�������������ķ�Ӧ������ƽ��Ĺ������������ʵ�������������ѹǿ���ʵ�������ѹǿ����ʱ���Ѵﵽƽ�⣻
C����Ӧ��(NH2COONH4)�ǹ������ʣ�����ƽ��������������������������ܶ����ʵ��ܱ������л��������ܶȲ��䣬�Ѵﵽƽ�⣻
D����Ӧ��(NH2COONH4)�ǹ������ʣ������ܱ�������NH3���������ʼ�ղ��䣬Ϊ![]() ���ܱ������а���������������䲻��˵����Ӧ�ﵽƽ��״̬��
���ܱ������а���������������䲻��˵����Ӧ�ﵽƽ��״̬��
�ʴ�ΪBC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���ȶ��£����ݻ�������ܱ������У��������¿��淴Ӧ��![]() �������ܱ����÷�Ӧ�Ѵﵽƽ��״̬����
�������ܱ����÷�Ӧ�Ѵﵽƽ��״̬����
��![]()
��![]()
��![]()
�ܻ�������ܶȱ��ֲ���
�ݻ�������ƽ��Ħ����������
A.����B.���ܢ�
C.���٢�D.���ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���÷���Ϊ��Ҫԭ��������ɫ�����������ƣ���ѧʽ��FeOOH����һ�ֹ����������£�
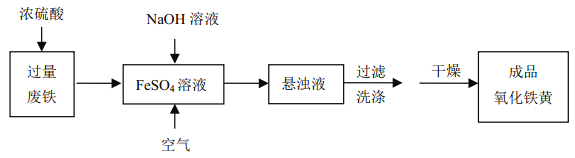
��Ҫ��Ӧ��4FeSO4+O2+8NaOH��4FeOOH��+4Na2SO4+2H2O�����������գ�
��1�������ڳ�ʪ�Ŀ����з���������ʴ��������ӦʽΪ___________________�������ĵ绯ѧ������һ������ӵ�����������������һ����______________������������
��2�������ڷ�Ӧǰ����ϴ�������ۣ�����ˮ��ƽ���ƶ�ԭ�����ͳ����ȵĴ�����Һ��ϴ�����������۵�ԭ��________________________________________________��
��3��FeSO4�������������¶�̫�ᷢ������Ӧ���������ɫ����[Fe(OH)3]�������ӷ���ʽ��_________________�� ___________________��
��4�������������Ƴ���ϴ���Ƿ���ȫ�ķ����ǣ������һ��ϴ��Һ�м���_______�Լ���������_______���������δϴ����ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����Ƴ��İ�����������(�ṹ��ͼ��ʾ��̼ԭ��δ����)��һ��������ըҩ����ը�ֽ�õ������ȶ������壬����˵����ȷ���� (����)
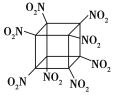
A. ������C��N���γɷǼ��Լ�B. 1 mol�÷����к�8 mol��������
C. �����ʼ������������л�ԭ��D. �����ʱ�ը������NO2��CO2��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����⣨![]() ��������̼��COS����������������ɱ������ش��������⣺
��������̼��COS����������������ɱ������ش��������⣺
��1����ԭ�ӵĺ�������Ų�ʽ______________��������______�ֲ�ͬ�����ĵ��ӣ����������____���˶�״̬��ͬ�ĵ��ӣ���Щ����ռ�ݵĹ����Ϊ____����
��2������̼�У�Ԫ�صķǽ�������ǿ��Ԫ�������ڱ��е�λ����______����֪COS��![]() �Ľṹ���ƣ���д��COS�ĵ���ʽ______________��COS����_____���ӣ����������������Ǽ���������
�Ľṹ���ƣ���д��COS�ĵ���ʽ______________��COS����_____���ӣ����������������Ǽ���������
����̼ˮ�⼰����Ӧ���������£����ֲ�������ȥ����
COS![]() H2S
H2S![]() Na2S
Na2S![]() M��Һ+H2
M��Һ+H2
��3��д����Ӧ������ӷ���ʽ��_____________________��
��4�����Ṥҵ�����нӴ����ڷ����ķ�Ӧ����ʽΪ___________����ʵ�������У������¶�ѡ��400~500�桢ѹǿͨ�����ó�ѹ��ԭ��ֱ���____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ںϳɰ���ӦN2(g)+3H2(g) ![]() 2NH3(g) H��0�������з�Ӧ���ʹ�ϵ�У���ȷ����
2NH3(g) H��0�������з�Ӧ���ʹ�ϵ�У���ȷ����
A��3 v (N2)��v(H2) B��v (N2)��3v(H2)
C��1.5v (H2)��v(NH3) D��v (N2)��2v(NH3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йغ��������������ʵ�顣

��.ij�о���ѧϰС��������ͼװ���о���������ʡ�
ʵ��һ����ͬѧ����ͼװ����֤ʵϡ������ͭ��Ӧ����NO
��1����A����U�ι���ע��ϡ���������������___��
��2�������ռ�NO����ĸ���װ���У���������___��(����ţ���ѡ������)

��3����100mL�����Һ�У�HNO3��H2SO4�����ʵ���Ũ�ȷֱ���0.4mol/L��0.1mol/L����û��Һ�м���1.92gͭ�ۣ����ȴ���ַ�Ӧ��������Һ��Cu2�������ʵ���Ũ����__��
ʵ���������ͬѧ��������װ�����Ũ������ͭ�ķ�Ӧ
��4������ͬѧ����ʵ�������м�ƿŨ����ʻ�ɫ�����û�ѧ����ʽ�ͼ�����˵�������������� ___��
��.ijͬѧ����ͼʵ��װ��(���м�ʯ��Ϊ�����������ƺ���ʯ�ҵĻ����)��ȡ��������ش��������⣺

��5��д����ȡ�����Ļ�ѧ����ʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش���������
(1)��֪�ڳ��³�ѹ�£���2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) H=-1275.6kJ��mol-1
��H2O(l)=H2O(g) H=+44.0 kJ��mol-1 д����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽ___________________________��
(2)��֪��CH3OH(g)+ ![]() O2(g)
O2(g)![]() CO2(g)+2H2(g) H1=-192.9kJ��mol-1
CO2(g)+2H2(g) H1=-192.9kJ��mol-1
H2(g)+ ![]() O2 (g)
O2 (g) ![]() H2O(g) H2=-120.9kJ��mol-1
H2O(g) H2=-120.9kJ��mol-1
��״���ˮ������������Ӧ���ʱ�H3________________��
(3)����ϩ����Ҫ�Ļ����л�ԭ�ϡ���ҵ�����ұ�(C6H5��CH2CH3)Ϊԭ�ϣ����ô�����ķ�����ȡ����ϩ(C6H5��CH=CH2)�ķ�Ӧ����ʽΪ:C6H5��CH2CH3(g)![]() C6H5��CH=CH2(g)+H2(g) H1
C6H5��CH=CH2(g)+H2(g) H1
��֪��3C2H2(g)![]() C6H6(g) H2��C6H6(g)+C2H4(g)
C6H6(g) H2��C6H6(g)+C2H4(g)![]() C6H5��CH2CH3(g) H3
C6H5��CH2CH3(g) H3
��Ӧ3C2H2(g)+C2H4(g)![]() C6H5��CH=CH2(g) +H2(g)��H =________��
C6H5��CH=CH2(g) +H2(g)��H =________��
(4)���ĺϳ�������Ҫ�Ļ�������֮һ����ҵ�Ϻϳɰ��õ�H2�ж�����ȡ�ķ�����
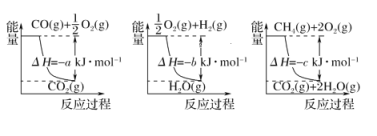
���ý�̿��ˮ��Ӧ��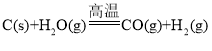 ��
��
������Ȼ����ˮ������Ӧ�� ��֪�йط�Ӧ�������仯��ͼ��ʾ�������з�Ӧ��H =________��
��֪�йط�Ӧ�������仯��ͼ��ʾ�������з�Ӧ��H =________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӵ�����ˮ����ȡ����������£�
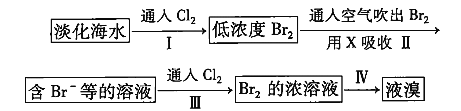
�����й�˵������ȷ����(����)
A.X����![]() ������Һ
������Һ
B.������������ӷ�ӦΪ![]()
C.��ҵ��ÿ���1 mol![]() ��������Ҫ���ı�״��
��������Ҫ���ı�״��![]() 22.4 L
22.4 L
D.������漰�IJ�������ȡ����Һ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com