
【题目】工业上用废铁为主要原料生产黄色颜料氧化铁黄(化学式:FeOOH)的一种工艺流程如下:
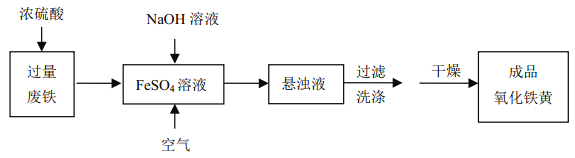
主要反应:4FeSO4+O2+8NaOH→4FeOOH↓+4Na2SO4+2H2O,完成下列填空:
(1)钢铁在潮湿的空气中发生吸氧腐蚀的正极反应式为___________________,钢铁的电化学保护有一种是外加电流阴极保护法,另一种是______________阴极保护法。
(2)废铁在反应前需清洗表面油污,请用水解平衡移动原理解释常用热的纯碱溶液清洗废铁表面油污的原因________________________________________________。
(3)FeSO4的氧化过程若温度太高会发生副反应而产生红褐色沉淀[Fe(OH)3],其离子方程式是_________________、 ___________________。
(4)检验氧化铁黄沉淀洗涤是否完全的方法是:向最后一次洗涤液中加入_______试剂,若出现_______现象则表明未洗涤完全。
【答案】 O2+2H2O +4e-→4OH- 牺牲阳极 CO32-+H2O![]() HCO3-+OH-,加热能促进纯碱水解,使 OH-浓度增大,增强了去油污的能力 Fe2++2OH-→Fe(OH)2↓ 4Fe(OH)2+O2+2H2O→4Fe(OH)3 BaCl2溶液 白色沉淀
HCO3-+OH-,加热能促进纯碱水解,使 OH-浓度增大,增强了去油污的能力 Fe2++2OH-→Fe(OH)2↓ 4Fe(OH)2+O2+2H2O→4Fe(OH)3 BaCl2溶液 白色沉淀
【解析】本题主要考查对于“工业上用废铁为主要原料生产黄色颜料氧化铁黄(化学式:FeOOH)的一种工艺流程”的评价。
(1)钢铁在潮湿的空气中发生吸氧腐蚀的正极反应式为O2+2H2O +4e-=4OH-,钢铁的电化学保护有一种是外加电流阴极保护法,另一种是牺牲阳极阴极保护法。
(2)用水解平衡移动原理解释常用热的纯碱溶液清洗废铁表面油污的原因:CO32-+H2O![]() HCO3-+OH-,加热能促进纯碱水解,使OH-浓度增大,增强了去油污的能力。
HCO3-+OH-,加热能促进纯碱水解,使OH-浓度增大,增强了去油污的能力。
(3)FeSO4的氧化过程若温度太高会发生副反应而产生红褐色沉淀[Fe(OH)3],其离子方程式是Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(4)氧化铁黄沉淀吸附悬浊液中的Na+、![]() 等离子,可以通过检验
等离子,可以通过检验![]() 的方法检验氧化铁黄沉淀洗涤是否完全,方法是:向最后一次洗涤液中加入BaCl2溶液,若出现白色沉淀现象则表明未洗涤完全。
的方法检验氧化铁黄沉淀洗涤是否完全,方法是:向最后一次洗涤液中加入BaCl2溶液,若出现白色沉淀现象则表明未洗涤完全。


科目:高中化学 来源: 题型:
【题目】对于硫酸和硝酸的比较中,下列叙述不正确的是
A.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装
B.浓硫酸和浓硝酸都具有很强的腐蚀性、脱水性
C.稀硫酸和稀硝酸都具有氧化性
D.硫酸和硝酸都是重要的化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应反应来制备甲醇.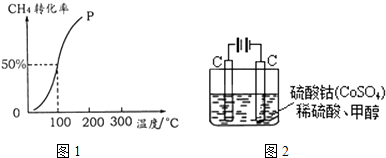
I:CH4 ( g )+H2O ( g )=CO ( g )+3H2 (g )△H=+206.0kJmol﹣1
II:CO ( g )+2H2 ( g )=CH3OH ( g )△H=﹣129.0kJmol﹣1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 .
(2)将1.0molCH4和2.0molH2O (g )通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图1.①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 .
②100℃时反应I的平衡常数为 .
(3)在压强为0.1Mpa、温度为300℃条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的 ![]() ,其他条件不变,对平衡体系产生的影响是 (填字母序号).
,其他条件不变,对平衡体系产生的影响是 (填字母序号).
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.c ( H2 )/c (CH3OH )减小
E.平衡常数K增大
(4)写出甲醇﹣空气﹣KOH溶液的燃料电池负极的电极反应式: .
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这污染,其原理如图2.通电后,Co2+放电变为Co3+ , 然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.①写出阳极电极反应式 .
②写出除去甲醇的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 利用化石燃料燃烧放出的热量使水分解产生氢气,是氢能开发的研究方向
B. 光合作用是将光能转化为化学能的有效途径
C. 石油、煤、天然气属于二次能源
D. 绿色化学最显著的特征是在生产化工产品过程中必须利用绿色植物为原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 F 是一种常见的化工原料,合成方法如下:
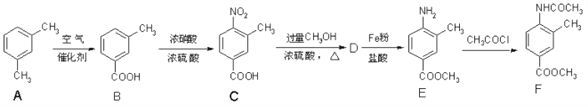
完成下列填空:
(1)化合物 C 中含氧官能团的名称是___________和__________。
(2)任写一种含苯环的 A 的同分异构体的结构简式: _________________。
(3)B→C 的反应类型是___________。
(4)写出 C→D 的化学方程式:_________________________________________。
(5)已知: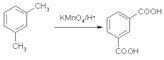 ,设计一条以
,设计一条以![]() 为原料合成
为原料合成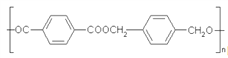 的合成路线。___________________。
的合成路线。___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、R、Y、Z、M为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示,R的原子序数大于Z。下列说法错误的是
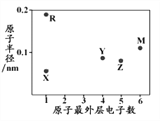
A. R的氧化物只含有离子键
B. 最高价含氧酸的酸性:Y<M
C. 最简单氢化物的稳定性:Y<Z
D. Z的简单氢化物可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.氯气可用于合成药物B.SO2环境污染大,工业生产中没有价值
C.纯碱在造纸工业中有着重要的应用D.硫酸铜可作泳池池水消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是( )
A.一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应:CH3COO﹣+H2OCH3COOH+OH﹣ , 使得溶液中的c(OH﹣)>c(H+)
B.在常温下,10 mL 0.2 molL﹣1盐酸与10 mL 0.2 molL﹣1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=13
C.在0.1 molL﹣1 NH4Cl溶液中:c(H+)+c(NH4+=c(Cl﹣)
D.5 mL 1 molL﹣1 CH3COONa溶液与5 mL 1 molL﹣1盐酸混合液中c(Cl﹣)=c(Na+)>c(H+)>c(OH﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com