
【题目】甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应反应来制备甲醇.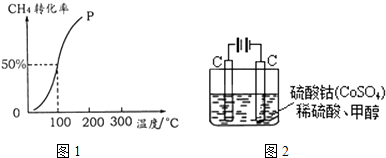
I:CH4 ( g )+H2O ( g )=CO ( g )+3H2 (g )△H=+206.0kJmol﹣1
II:CO ( g )+2H2 ( g )=CH3OH ( g )△H=﹣129.0kJmol﹣1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 .
(2)将1.0molCH4和2.0molH2O (g )通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图1.①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 .
②100℃时反应I的平衡常数为 .
(3)在压强为0.1Mpa、温度为300℃条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的 ![]() ,其他条件不变,对平衡体系产生的影响是 (填字母序号).
,其他条件不变,对平衡体系产生的影响是 (填字母序号).
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.c ( H2 )/c (CH3OH )减小
E.平衡常数K增大
(4)写出甲醇﹣空气﹣KOH溶液的燃料电池负极的电极反应式: .
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这污染,其原理如图2.通电后,Co2+放电变为Co3+ , 然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.①写出阳极电极反应式 .
②写出除去甲醇的离子方程式 .
【答案】
(1)CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+77.0 kJ/mol
(2)0.003mol?L﹣1?min﹣1;2.25×10﹣4
(3)CD
(4)CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O
(5)Co2+﹣e﹣=Co3+;6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
【解析】解:(1)①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol ②CO(g)+2H2(g)=CH3OH(g)△H=+129.0kJ/mol将方程式①﹣②得CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+206.0kJ/mol﹣(﹣129.0kJ/mol)=+77.0 kJ/mol,故答案为:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+77.0kJ/mol;(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为100L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO(g)+3H2 (g)
起始量(mol):1.0 2.00 0
变化量(mol):0.5 0.50.5 1.5
平衡量(mol):0.5 1.50.5 1.5
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率= ![]() =0.003 molL﹣1min﹣1 , 故答案为:0.003 molL﹣1min﹣1;②100℃时反应I的平衡浓度为c(CH4)=0.050mol/L,c(H2O)=0.015mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,平衡常数K=
=0.003 molL﹣1min﹣1 , 故答案为:0.003 molL﹣1min﹣1;②100℃时反应I的平衡浓度为c(CH4)=0.050mol/L,c(H2O)=0.015mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,平衡常数K= ![]() =2.25×10﹣4 , 故答案为:2.25×10﹣4;(3)A.平衡后将容器的容积压缩到原来的
=2.25×10﹣4 , 故答案为:2.25×10﹣4;(3)A.平衡后将容器的容积压缩到原来的 ![]() ,压强增大,平衡向正反应方向移动,生成物的浓度增大,由于平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,故A错误; B.压强增大,正、逆反应速率都增大,但正反应速率增大更多,故B错误; C.压强增大,平衡向正反应方向移动,CH3OH 的物质的量增加,故C正确; D.压强增大,平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡
,压强增大,平衡向正反应方向移动,生成物的浓度增大,由于平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,故A错误; B.压强增大,正、逆反应速率都增大,但正反应速率增大更多,故B错误; C.压强增大,平衡向正反应方向移动,CH3OH 的物质的量增加,故C正确; D.压强增大,平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡 ![]() 减小,故D正确; E.平衡常数只受温度影响,温度不变,平衡常数不变,故E错误,故答案为:CD;(4)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根与水,负极电极反应式为:CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O,故答案为:CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O;(5)①通电后,将Co2+氧化成Co3+ , 电解池中阳极失电子发生氧化反应,电极反应为Co2+﹣e﹣=Co3+ , 故答案为:Co2+﹣e﹣=Co3+;②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+ , 结合原子守恒与电荷守恒可知,还原生成H+ , 配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+ , 故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+ .
减小,故D正确; E.平衡常数只受温度影响,温度不变,平衡常数不变,故E错误,故答案为:CD;(4)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根与水,负极电极反应式为:CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O,故答案为:CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O;(5)①通电后,将Co2+氧化成Co3+ , 电解池中阳极失电子发生氧化反应,电极反应为Co2+﹣e﹣=Co3+ , 故答案为:Co2+﹣e﹣=Co3+;②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+ , 结合原子守恒与电荷守恒可知,还原生成H+ , 配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+ , 故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+ .
(1)①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol ②CO(g)+2 H2(g)=CH3OH(g)△H=+129.0 kJ/mol将方程式①﹣②得;(2)100℃时达到平衡时,甲烷转化率为50%,结合化学平衡三段式列式计算平衡时各组分的物质的量,①根据c= ![]() 计算v(H2)②计算平衡状态时各物质的浓度,代入平衡常数表达式计算;(3)其他条件不变,平衡后将容器的容积压缩到原来的
计算v(H2)②计算平衡状态时各物质的浓度,代入平衡常数表达式计算;(3)其他条件不变,平衡后将容器的容积压缩到原来的 ![]() ,压强增大,正、逆反应速率都增大,但正反应速率增大更多,平衡向正反应方向移动,生成物的浓度增大,由于温度不变,则平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,据此分析解答;(4)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根与水;(5)①通电后,将Co2+氧化成Co3+ , 电解池中阳极失电子发生氧化反应,电极反应为Co2+﹣e﹣=Co3+;②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+ , 原子守恒与电荷守恒可知,还原生成H+ , 配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;③负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根与水;利用电池反应方程式2CH3OH+3O2+4KOH═2K2CO3+6H20分析.
,压强增大,正、逆反应速率都增大,但正反应速率增大更多,平衡向正反应方向移动,生成物的浓度增大,由于温度不变,则平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,据此分析解答;(4)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根与水;(5)①通电后,将Co2+氧化成Co3+ , 电解池中阳极失电子发生氧化反应,电极反应为Co2+﹣e﹣=Co3+;②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+ , 原子守恒与电荷守恒可知,还原生成H+ , 配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;③负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根与水;利用电池反应方程式2CH3OH+3O2+4KOH═2K2CO3+6H20分析.


科目:高中化学 来源: 题型:
【题目】Li-Cu-空气燃料电池的原理示意如图,电池通入空气腐蚀铜电极而产生正极反应物Cu2O。下列有关说法正确的是
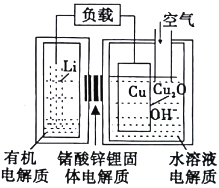
A. 电池工作时,正极上有金属锂析出
B. 电池工作时,负极区溶液中c(OH-)增大
C. 电池放电过程中的总反应为:2Cu+2Li++2OH-=2Li+Cu2O+H2O
D. 停止通入空气一段时间,电池将停止放电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是
A. 用规格为10mL的量筒量取6mL的液体
B. 用药匙或者纸槽把粉末状药品送入试管底部
C. 过滤时玻璃棒的末端应轻轻的靠在三层的滤纸上
D. 如果没有试管夹,可以临时手持试管给固体或液体加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L 0.1mol/L的AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断正确的是( )
A.电解质AgNO3溶液的浓度变为0.08mol/L
B.阳极上产生112mLO2(标况)
C.转移1.204×1022个电子
D.反应中有0.01mol的Ag被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将1mol NH4NO3溶于水,向该溶液滴加b L氨水后溶液呈中性,据此判断下列说法中不正确的是(NH3H2O的电离平衡常数取Kb=2×10﹣5molL﹣1)( )
A.滴加氨水的过程中,水的电离平衡将正向移动
B.滴加b L氨水后的溶液中,n(NH ![]() )=200 n(NH3?H2O)=1mol
)=200 n(NH3?H2O)=1mol
C.所滴加氨水的浓度为0.005/b mol?L﹣1
D.滴加b L氨水后的溶液中各离子浓度大小是:c(NH ![]() )=c(NO3﹣)>c(H+)=c(OH﹣)
)=c(NO3﹣)>c(H+)=c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于酸、碱、盐的下列各种说法中,正确的是
A. 化合物电离时,生成的阳离子有氢离子的是酸
B. 化合物电离时,生成的阴离子有氢氧根离子的是碱
C. 化合物电离时,生成金属阳离子(或NH4+)和酸根离子的是盐
D. NH4Cl电离的电离方程式是:NH4Cl=NH4++Cl-,所以NH4Cl不是盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用废铁为主要原料生产黄色颜料氧化铁黄(化学式:FeOOH)的一种工艺流程如下:
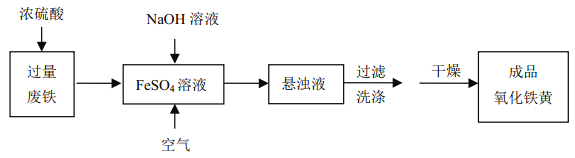
主要反应:4FeSO4+O2+8NaOH→4FeOOH↓+4Na2SO4+2H2O,完成下列填空:
(1)钢铁在潮湿的空气中发生吸氧腐蚀的正极反应式为___________________,钢铁的电化学保护有一种是外加电流阴极保护法,另一种是______________阴极保护法。
(2)废铁在反应前需清洗表面油污,请用水解平衡移动原理解释常用热的纯碱溶液清洗废铁表面油污的原因________________________________________________。
(3)FeSO4的氧化过程若温度太高会发生副反应而产生红褐色沉淀[Fe(OH)3],其离子方程式是_________________、 ___________________。
(4)检验氧化铁黄沉淀洗涤是否完全的方法是:向最后一次洗涤液中加入_______试剂,若出现_______现象则表明未洗涤完全。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g) ![]() 2SO3(g)△H =-198kJ·mol-1。400℃,1.01×105Pa,向容积为2L 的恒容密闭容器中充入一定量SO2和O2,n(SO3)和n(O2)等随时间的变化曲线如图所示。下列叙述正确的是
2SO3(g)△H =-198kJ·mol-1。400℃,1.01×105Pa,向容积为2L 的恒容密闭容器中充入一定量SO2和O2,n(SO3)和n(O2)等随时间的变化曲线如图所示。下列叙述正确的是

A. A点v 正(SO2) >v 逆(SO3) B. B点表示反应处于平衡状态
C. D点n(SO2)大于C点 D. 其它条件不变,升温至500℃并达平衡时,n(SO3)比图中D 点的值大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中正确的是( )
A.KOH═K++OH﹣ B.NaHCO3═Na++H++CO32﹣
C.H2SO4═2H++SO42﹣ D.Fe2(SO4)3═Fe23++3SO42﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com