
【题目】已知2SO2(g)+O2(g) ![]() 2SO3(g)△H =-198kJ·mol-1。400℃,1.01×105Pa,向容积为2L 的恒容密闭容器中充入一定量SO2和O2,n(SO3)和n(O2)等随时间的变化曲线如图所示。下列叙述正确的是
2SO3(g)△H =-198kJ·mol-1。400℃,1.01×105Pa,向容积为2L 的恒容密闭容器中充入一定量SO2和O2,n(SO3)和n(O2)等随时间的变化曲线如图所示。下列叙述正确的是

A. A点v 正(SO2) >v 逆(SO3) B. B点表示反应处于平衡状态
C. D点n(SO2)大于C点 D. 其它条件不变,升温至500℃并达平衡时,n(SO3)比图中D 点的值大
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)某气态烃在标准状况下的体积为2.8 L,其质量为2 g,该烃中氢元素的质量分数为25%,则该烃的分子式为________,电子式为____________,结构式为____________,其立体构型为________。
(2)如图立方体中心的“●”表示甲烷分子中的碳原子,请在立方体的顶点用“●”表示出与之紧邻的4个氢原子的位置。______________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应反应来制备甲醇.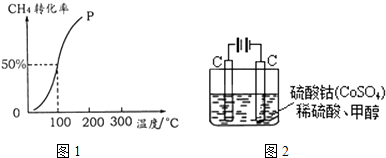
I:CH4 ( g )+H2O ( g )=CO ( g )+3H2 (g )△H=+206.0kJmol﹣1
II:CO ( g )+2H2 ( g )=CH3OH ( g )△H=﹣129.0kJmol﹣1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 .
(2)将1.0molCH4和2.0molH2O (g )通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图1.①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 .
②100℃时反应I的平衡常数为 .
(3)在压强为0.1Mpa、温度为300℃条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的 ![]() ,其他条件不变,对平衡体系产生的影响是 (填字母序号).
,其他条件不变,对平衡体系产生的影响是 (填字母序号).
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.c ( H2 )/c (CH3OH )减小
E.平衡常数K增大
(4)写出甲醇﹣空气﹣KOH溶液的燃料电池负极的电极反应式: .
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这污染,其原理如图2.通电后,Co2+放电变为Co3+ , 然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.①写出阳极电极反应式 .
②写出除去甲醇的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 F 是一种常见的化工原料,合成方法如下:
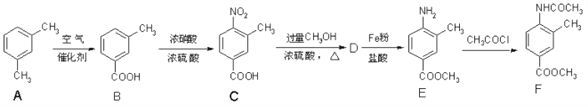
完成下列填空:
(1)化合物 C 中含氧官能团的名称是___________和__________。
(2)任写一种含苯环的 A 的同分异构体的结构简式: _________________。
(3)B→C 的反应类型是___________。
(4)写出 C→D 的化学方程式:_________________________________________。
(5)已知: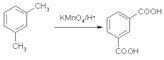 ,设计一条以
,设计一条以![]() 为原料合成
为原料合成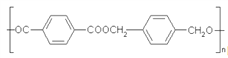 的合成路线。___________________。
的合成路线。___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、R、Y、Z、M为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示,R的原子序数大于Z。下列说法错误的是
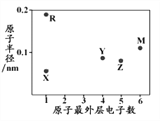
A. R的氧化物只含有离子键
B. 最高价含氧酸的酸性:Y<M
C. 最简单氢化物的稳定性:Y<Z
D. Z的简单氢化物可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将HA和HB两种一元酸的溶液分别加水稀释,稀释时溶液pH的变化如图所示。则下列叙述中正确的是
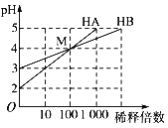
A. 稀释前,c(HA)=10c(HB)
B. 在M点两种溶液中水的电离程度相同
C. pH=a的0.1 mol·L-1HB溶液与pH=b0.01 mol·L-1HB溶液相比,a+1<b
D. 加水稀释HB溶液,HB的电离度增大,c(H+)/c(HB)减小,溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.氯气可用于合成药物B.SO2环境污染大,工业生产中没有价值
C.纯碱在造纸工业中有着重要的应用D.硫酸铜可作泳池池水消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子.
(1)Y基态原子的电子排布式是;Z所在周期中第一电离能最大的主族元素是
(2)XY2﹣离子的立体构型是;R2+的水合离子中,提供孤电子对的原子是 .
(3)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是 . 
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2 , 充分反应后溶液呈深蓝色,该反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是( )
A.pH相等的①NH4Cl溶液、②(NH4)2SO4溶液、③NH4HSO4溶液,溶液中c(NH4+)的大小顺序为①>②>③
B.pH相等的NaF溶液与CH3COOK溶液:[c(Na+)﹣c(F﹣)]>[c(K+)﹣c(CH3COO﹣)]
C.0.2 mol?L﹣1Na2CO3溶液:c(OH﹣)=c(HCO![]() )+c(H+)+c(H2CO3)
)+c(H+)+c(H2CO3)
D.0.2 mol?L﹣1盐酸与0.1 mol?L﹣1NaAlO2溶液等体积混合:c(Cl﹣)>c(Na+)>c(Al3+)>c(H+)>c(OH﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com