
【题目】1L 0.1mol/L的AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断正确的是( )
A.电解质AgNO3溶液的浓度变为0.08mol/L
B.阳极上产生112mLO2(标况)
C.转移1.204×1022个电子
D.反应中有0.01mol的Ag被氧化
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验,将分液漏斗中溶液X加入圆底烧瓶中与Y反应,对试管B中现象描述不正确的是
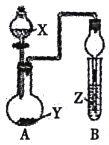
选项 | X溶液 | 固体Y | Z溶液 | 现象 |
A | 70%H2SO4 | Na2SO3溶液 | H2S溶液 | 产生浑浊 |
B | 浓氨水 | CaO | 酚酞试剂 | 溶液变红 |
C | 盐酸 | 大理石 | Na2SiO3溶液 | 出现白色沉淀 |
D | 浓盐酸 | MnO2 | NaOH溶液 | 黄绿色气体被吸收 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某气态烃在标准状况下的体积为2.8 L,其质量为2 g,该烃中氢元素的质量分数为25%,则该烃的分子式为________,电子式为____________,结构式为____________,其立体构型为________。
(2)如图立方体中心的“●”表示甲烷分子中的碳原子,请在立方体的顶点用“●”表示出与之紧邻的4个氢原子的位置。______________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学为了探究NO的性质,进行了如下实验。
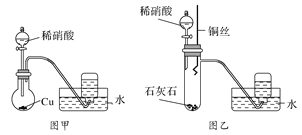
(1)甲同学设计了图甲装置进行实验,观察到集气瓶中收集到无色气体,由此确定铜和稀硝酸反应生成NO气体。甲同学的推断________(填“正确”或“不正确”),理由是_____________________________________。
(2)乙同学不同意甲同学的推断,他观察到图甲装置圆底烧瓶中的气体不是无色。为此乙同学设计了图乙装置进行实验,步骤为:
①在大试管中放入适量石灰石,加入过量稀硝酸;
②待石灰石反应完全,将铜丝浸入过量的稀硝酸中;
③一段时间后,观察到大试管中气体始终为无色,收集反应产生的气体;
④待集气瓶充满气体后从水槽中取出,敞口正放在桌面上,观察到瓶口气体颜色有变化,证明稀硝酸与铜反应生成NO。
步骤①的作用是:__________________;步骤④瓶口气体的颜色变化是____________________。
(3)当过量的铜与稀硝酸完全反应后,再加入20%的稀硫酸,铜片上又有气泡产生,稀硫酸的作用是________(填正确选项的编号),反应的离子方程式是:________________________。
a.还原剂 b.氧化剂
c.酸化 d.提供热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于硫酸和硝酸的比较中,下列叙述不正确的是
A.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装
B.浓硫酸和浓硝酸都具有很强的腐蚀性、脱水性
C.稀硫酸和稀硝酸都具有氧化性
D.硫酸和硝酸都是重要的化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.采用原煤脱硫技术,可减少燃煤燃烧时产生的SO2
B.自来水可用氯气来杀菌消毒,说明氯气无毒
C.氮氧化物可以破坏臭氧层,也能形成酸雨
D.化石燃料燃烧产生大量CO2,会导致温室效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应反应来制备甲醇.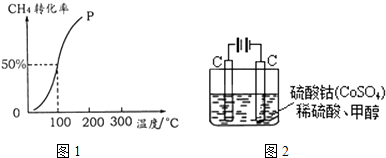
I:CH4 ( g )+H2O ( g )=CO ( g )+3H2 (g )△H=+206.0kJmol﹣1
II:CO ( g )+2H2 ( g )=CH3OH ( g )△H=﹣129.0kJmol﹣1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 .
(2)将1.0molCH4和2.0molH2O (g )通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图1.①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 .
②100℃时反应I的平衡常数为 .
(3)在压强为0.1Mpa、温度为300℃条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的 ![]() ,其他条件不变,对平衡体系产生的影响是 (填字母序号).
,其他条件不变,对平衡体系产生的影响是 (填字母序号).
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.c ( H2 )/c (CH3OH )减小
E.平衡常数K增大
(4)写出甲醇﹣空气﹣KOH溶液的燃料电池负极的电极反应式: .
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这污染,其原理如图2.通电后,Co2+放电变为Co3+ , 然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.①写出阳极电极反应式 .
②写出除去甲醇的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 F 是一种常见的化工原料,合成方法如下:
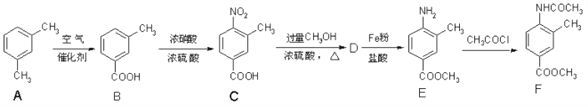
完成下列填空:
(1)化合物 C 中含氧官能团的名称是___________和__________。
(2)任写一种含苯环的 A 的同分异构体的结构简式: _________________。
(3)B→C 的反应类型是___________。
(4)写出 C→D 的化学方程式:_________________________________________。
(5)已知: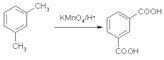 ,设计一条以
,设计一条以![]() 为原料合成
为原料合成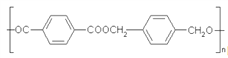 的合成路线。___________________。
的合成路线。___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子.
(1)Y基态原子的电子排布式是;Z所在周期中第一电离能最大的主族元素是
(2)XY2﹣离子的立体构型是;R2+的水合离子中,提供孤电子对的原子是 .
(3)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是 . 
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2 , 充分反应后溶液呈深蓝色,该反应的离子方程式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com