
����Ŀ��25��ʱ����1mol NH4NO3����ˮ�������Һ�μ�b L��ˮ����Һ�����ԣ��ݴ��ж�����˵���в���ȷ���ǣ�NH3H2O�ĵ���ƽ�ⳣ��ȡKb=2��10��5molL��1���� ��
A.�μӰ�ˮ�Ĺ����У�ˮ�ĵ���ƽ�⽫�����ƶ�
B.�μ�b L��ˮ�����Һ�У�n��NH ![]() ��=200 n��NH3?H2O��=1mol
��=200 n��NH3?H2O��=1mol
C.���μӰ�ˮ��Ũ��Ϊ0.005/b mol?L��1
D.�μ�b L��ˮ�����Һ�и�����Ũ�ȴ�С�ǣ�c��NH ![]() ��=c��NO3������c��H+��=c��OH����
��=c��NO3������c��H+��=c��OH����
���𰸡�A
���������⣺A��笠�����ˮ��ٽ�ˮ�ĵ��룬�������Һ��笠�����ˮ�������ԣ���Һ�м��백ˮ��������Һ������ˮ�ĵ��룬ˮ�ĵ���ƽ�������ƶ�����A����B����1molNH4NO3����ˮ�������Һ�μ�bL ��ˮ����Һ�����ԣ����ݵ���غ�����֪����Һ������������Ũ��=10��7mol/L��c��NH ![]() ��=c��NO3������NH3H2O�ĵ���ƽ�ⳣ��ȡKb=2��10��5 molL��1 �� ���Ϻ���Һ���Ϊ1L����NH
��=c��NO3������NH3H2O�ĵ���ƽ�ⳣ��ȡKb=2��10��5 molL��1 �� ���Ϻ���Һ���Ϊ1L����NH ![]() ��=c��NO3����=1mol/L������һˮ�ϰ�����ƽ��õ���NH3H2ONH4++OH�� �� ƽ�ⳣ��K=
��=c��NO3����=1mol/L������һˮ�ϰ�����ƽ��õ���NH3H2ONH4++OH�� �� ƽ�ⳣ��K= ![]() =
=  =2��10��5 molL��1 �� ����õ�c��NH3H2O��=
=2��10��5 molL��1 �� ����õ�c��NH3H2O��= ![]() mol/L��n��NH3H2O��=
mol/L��n��NH3H2O��= ![]() mol����NH
mol����NH ![]() ��=c��NO3����=1mol/L���μ�b L��ˮ�����Һ�У�n��NH
��=c��NO3����=1mol/L���μ�b L��ˮ�����Һ�У�n��NH ![]() ��=200 n��NH3H2O��=1mol����B��ȷ��
��=200 n��NH3H2O��=1mol����B��ȷ��
C����1mol NH4NO3����ˮ�������Һ�μ�bL ��ˮ����Һ�����ԣ����ݵ���غ�����֪����Һ������������Ũ��=10��7mol/L��c��NH ![]() ��=c��NO3������NH3H2O�ĵ���ƽ�ⳣ��ȡKb=2��10��5 molL��1 �� ���Ϻ���Һ���Ϊ1L����NH
��=c��NO3������NH3H2O�ĵ���ƽ�ⳣ��ȡKb=2��10��5 molL��1 �� ���Ϻ���Һ���Ϊ1L����NH ![]() ��=c��NO3����=1mol/L������һˮ�ϰ�����ƽ��õ���NH3H2ONH4++OH�� �� ƽ�ⳣ��K=
��=c��NO3����=1mol/L������һˮ�ϰ�����ƽ��õ���NH3H2ONH4++OH�� �� ƽ�ⳣ��K= ![]() =
=  =2��10��5 molL��1 �� ����õ�c��NH3H2O��=
=2��10��5 molL��1 �� ����õ�c��NH3H2O��= ![]() mol/L����C��ȷ��
mol/L����C��ȷ��
D����Һ�д��ڵ���غ㣬c��NH4+��+c��H+��=c��OH����+c��NO3�������õ�c��NH ![]() ��=c��NO
��=c��NO ![]() ����c��H+��=c��OH�������õ�c��NH
����c��H+��=c��OH�������õ�c��NH ![]() ��=c��NO3������c��H+��=c��OH��������D��ȷ��
��=c��NO3������c��H+��=c��OH��������D��ȷ��
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�еμ�0.1mol/Lϡ���ᣬCO2���������������������(V)�Ĺ�ϵ��ͼ��ʾ�����ж���Һ��������ɳɷ��ж���ȷ����( ��
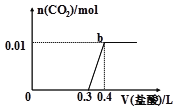
A. ԭ��Һ������ΪNa2CO3��NaHCO3
B. ԭ��Һ������ΪNaOH��Na2CO3
C. ԭ��Һ������ΪNa2CO3
D. ԭ��Һ������ΪNaHCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ڵ���ʵ���
A. SO2 B. (NH4)2SO4 C. Cl2 D. NaCl��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ıȽ��У�������������ȷ����
A.���Ũ�����Ũ���ᶼ������������������ʢװ
B.Ũ�����Ũ���ᶼ���к�ǿ�ĸ�ʴ�ԡ���ˮ��
C.ϡ�����ϡ���ᶼ����������
D.��������ᶼ����Ҫ�Ļ���ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ü�������������ȡ����Ӧ��ȡ����Ʒ����������ڹ�ҵ���ѳ�Ϊ��ʵ��ij��ѧ��ȤС��ͨ����ʵ������ģ���������̣�����Ƶ�ģ��װ�����£�

�������Ҫ��ش�
��1��Bװ�������ֹ��ܣ������������ٶȣ������Ȼ�����壻��________��
��2����V(Cl2)/V(CH4)=x��������������������Ȼ��⣬��xֵӦ________��
��3��Dװ�õ�ʯ���о��Ȼ���KI��ĩ����������________________________________________��
��4��Eװ�õ�������____________(����)��
A���ռ����� B����������
C����ֹ���� D�������Ȼ���
��5����Cװ���У�����һ��ʱ���ǿ�����䣬����Ӳ�ʲ������ڱ��к�ɫС����������д���û�����ɫС�����Ļ�ѧ����ʽ____________________________________��
��6��Eװ�ó����������⣬�������л����E�з�����л������ѷ���Ϊ________����װ�û���ȱ�ݣ�ԭ����û�н���β����������β����Ҫ�ɷ�Ϊ______(����)��
a��CH4�� b��CH3Cl ��c��CH2Cl2�� d��CHCl3 ��e��CCl4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ϊȼ�ϵ�ص�ԭ�ϣ���CH4��H2OΪԭ�ϣ�ͨ�����з�Ӧ��Ӧ���Ʊ��״���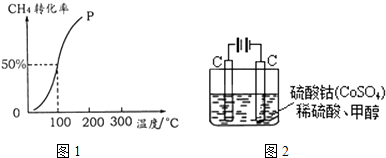
I��CH4 �� g ��+H2O �� g ��=CO �� g ��+3H2 ��g ����H=+206.0kJmol��1
II��CO �� g ��+2H2 �� g ��=CH3OH �� g ����H=��129.0kJmol��1
��1��CH4��g����H2O��g����Ӧ����CH3OH ��g����H2��g�����Ȼ�ѧ����ʽΪ ��
��2����1.0molCH4��2.0molH2O ��g ��ͨ���ݻ�Ϊ100L�ķ�Ӧ�ң���һ�������·�����ӦI�������һ����ѹǿ��CH4��ת�������¶ȵĹ�ϵ��ͼ1���ټ���100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ ��
��100��ʱ��ӦI��ƽ�ⳣ��Ϊ ��
��3����ѹǿΪ0.1Mpa���¶�Ϊ300�������£���a mol CO�� 3a mol H2�Ļ�������ڴ��������·�����ӦII���ɼ״���ƽ����������ݻ�ѹ����ԭ���� ![]() �������������䣬��ƽ����ϵ������Ӱ���� ������ĸ��ţ���
�������������䣬��ƽ����ϵ������Ӱ���� ������ĸ��ţ���
A.c��H2������
B.����Ӧ���ʼӿ죬�淴Ӧ���ʼ���
C.CH3OH �����ʵ�������
D.c �� H2 ��/c ��CH3OH ����С
E.ƽ�ⳣ��K����
��4��д���״���������KOH��Һ��ȼ�ϵ�ظ����ĵ缫��Ӧʽ�� ��
��5���״���ˮ�ʻ����һ������Ⱦ����һ�ֵ绯ѧ������������Ⱦ����ԭ����ͼ2��ͨ���Co2+�ŵ��ΪCo3+ �� Ȼ����Co3+����������ˮ�еļ״�������CO2����������д�������缫��Ӧʽ ��
��д����ȥ�״������ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ���û�ʯȼ��ȼ�շų�������ʹˮ�ֽ���������������ܿ������о�����
B. ��������ǽ�����ת��Ϊ��ѧ�ܵ���Ч;��
C. ʯ�͡�ú����Ȼ�����ڶ�����Դ
D. ��ɫ��ѧ��������������������������Ʒ�����б���������ɫֲ��Ϊԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��R��Y��Z��MΪ���ֶ�����Ԫ�أ���ԭ�Ӱ뾶������������֮��Ĺ�ϵ����ͼ��ʾ��R��ԭ����������Z������˵���������
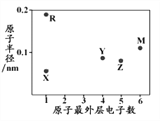
A. R��������ֻ�������Ӽ�
B. ��ۺ����������:Y<M
C. ����⻯����ȶ���:Y<Z
D. Z�ļ��⻯������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С���ͬѧΪ̽���ͱȽ�SO2����ˮ��Ư���ԣ���������µ�ʵ��װ�á�
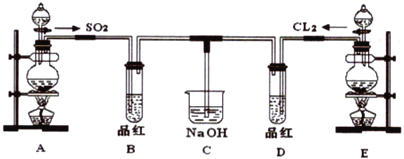
��1��ʵ������װ��A�Ʊ�SO2��ijͬѧ��ʵ��ʱ���ִ�A�ķ�Һ©��������©����Һ��δ���£�����Ϊԭ������ǣ�_________________________________________��
��2��ʵ������װ��E�Ʊ�Cl2���䷴Ӧ��ѧ��ѧ����ʽΪ��MnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
��ָ���÷�Ӧ���ڷ�Ӧ��HCl(Ũ)�����ֳ��Ļ�ѧ����_____________��___________��
����ѣ�2���еĻ�ѧ����ʽ��дΪ���ӷ���ʽ_______________________________________��
��3���ٷ�Ӧ��ʼһ��ʱ��۲쵽B��D�����Թ��е�Ʒ����Һ����__________������(��ѡ���ͬ��
A.Ʒ�춼��ɫ B.Ʒ�춼����ɫ
C.�Թ�B ��Ʒ����ɫD �в���ɫ D.�Թ�D ��Ʒ����ɫB �в���ɫ
��ֹͣͨ�����ٸ�B��D�����Թֱܷ���ȣ������Թ��е������ֱַ�Ϊ__________��
A.��ɫ ��ɫ B.��ɫ ��ɫ C.��ɫ ��ɫ D.��ɫ ��ɫ
��4��C �ձ�����������Һ��������________________________��
��5����һ��ʵ��С���ͬѧ��ΪSO2 ����ˮ����Ư���ԣ�����Ϻ��Ư���Կ϶����ǿ�����ǽ��Ƶõ�SO2��Cl2��1��1ͬʱͨ�뵽Ʒ����Һ�У����������ɫЧ���������������������������������ԭ���û�ѧ����ʽ��ʾ��_________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com