
【题目】下列实验操作中错误的是
A. 用规格为10mL的量筒量取6mL的液体
B. 用药匙或者纸槽把粉末状药品送入试管底部
C. 过滤时玻璃棒的末端应轻轻的靠在三层的滤纸上
D. 如果没有试管夹,可以临时手持试管给固体或液体加热
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】H、C、N、O、F、Se是六种重要的非金属元素。请根据所学的物质结构与性质的相关知识回答下列问题:
(1)基态氮原子最高能级上电子的自旋方向有________种,基态硒原子的价层电子排布式为________,N元素第一电离能大于O元素第一电离能的原因为____________。
(2)某高效低毒的新型农药的结构简式为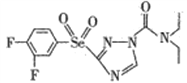 ,则该物质中氮原子的杂化轨道类型为________,其分子之间________(填“能”或“不能”)形成氢键。
,则该物质中氮原子的杂化轨道类型为________,其分子之间________(填“能”或“不能”)形成氢键。
(3)SeO2、SeO2两种分子中,属于非极性分子的是________,SeO2的空间构型为________,与SeO3互为等电子体的分子和离子为________。(各写一种)
(4)氮化硼(BN)晶体有多种结构,六方相氮化硼(晶体结构如图1)是通常存在的稳定相,可作高温润滑剂,立方相氮化硼(晶体结构如图2)是超硬材料,有优异的耐磨性。
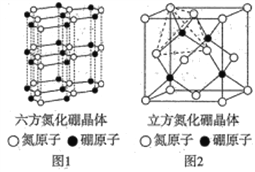
①下列关于这两种晶体的说法正确的是________ (填字母)。
a.两种晶体存在的作用力相同 b.立方氮化硼晶体可用于生产金属切割刀片
c.六方相氮化硼层间作用力小,所以质地软 d.立方相氮化硼含有σ键和π键,所以硬度大
②若图2中晶胞的边长为anm,密度为ρg·cm-3,则阿伏加德罗常数的值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某气态烃在标准状况下的体积为2.8 L,其质量为2 g,该烃中氢元素的质量分数为25%,则该烃的分子式为________,电子式为____________,结构式为____________,其立体构型为________。
(2)如图立方体中心的“●”表示甲烷分子中的碳原子,请在立方体的顶点用“●”表示出与之紧邻的4个氢原子的位置。______________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学为了探究NO的性质,进行了如下实验。
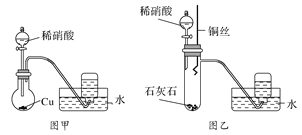
(1)甲同学设计了图甲装置进行实验,观察到集气瓶中收集到无色气体,由此确定铜和稀硝酸反应生成NO气体。甲同学的推断________(填“正确”或“不正确”),理由是_____________________________________。
(2)乙同学不同意甲同学的推断,他观察到图甲装置圆底烧瓶中的气体不是无色。为此乙同学设计了图乙装置进行实验,步骤为:
①在大试管中放入适量石灰石,加入过量稀硝酸;
②待石灰石反应完全,将铜丝浸入过量的稀硝酸中;
③一段时间后,观察到大试管中气体始终为无色,收集反应产生的气体;
④待集气瓶充满气体后从水槽中取出,敞口正放在桌面上,观察到瓶口气体颜色有变化,证明稀硝酸与铜反应生成NO。
步骤①的作用是:__________________;步骤④瓶口气体的颜色变化是____________________。
(3)当过量的铜与稀硝酸完全反应后,再加入20%的稀硫酸,铜片上又有气泡产生,稀硫酸的作用是________(填正确选项的编号),反应的离子方程式是:________________________。
a.还原剂 b.氧化剂
c.酸化 d.提供热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于硫酸和硝酸的比较中,下列叙述不正确的是
A.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装
B.浓硫酸和浓硝酸都具有很强的腐蚀性、脱水性
C.稀硫酸和稀硝酸都具有氧化性
D.硫酸和硝酸都是重要的化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应反应来制备甲醇.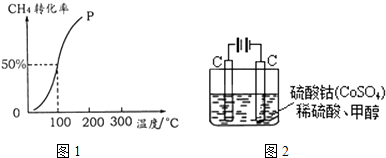
I:CH4 ( g )+H2O ( g )=CO ( g )+3H2 (g )△H=+206.0kJmol﹣1
II:CO ( g )+2H2 ( g )=CH3OH ( g )△H=﹣129.0kJmol﹣1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 .
(2)将1.0molCH4和2.0molH2O (g )通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图1.①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 .
②100℃时反应I的平衡常数为 .
(3)在压强为0.1Mpa、温度为300℃条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的 ![]() ,其他条件不变,对平衡体系产生的影响是 (填字母序号).
,其他条件不变,对平衡体系产生的影响是 (填字母序号).
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.c ( H2 )/c (CH3OH )减小
E.平衡常数K增大
(4)写出甲醇﹣空气﹣KOH溶液的燃料电池负极的电极反应式: .
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这污染,其原理如图2.通电后,Co2+放电变为Co3+ , 然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.①写出阳极电极反应式 .
②写出除去甲醇的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.氯气可用于合成药物B.SO2环境污染大,工业生产中没有价值
C.纯碱在造纸工业中有着重要的应用D.硫酸铜可作泳池池水消毒剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com