
【题目】H、C、N、O、F、Se是六种重要的非金属元素。请根据所学的物质结构与性质的相关知识回答下列问题:
(1)基态氮原子最高能级上电子的自旋方向有________种,基态硒原子的价层电子排布式为________,N元素第一电离能大于O元素第一电离能的原因为____________。
(2)某高效低毒的新型农药的结构简式为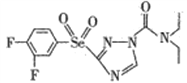 ,则该物质中氮原子的杂化轨道类型为________,其分子之间________(填“能”或“不能”)形成氢键。
,则该物质中氮原子的杂化轨道类型为________,其分子之间________(填“能”或“不能”)形成氢键。
(3)SeO2、SeO2两种分子中,属于非极性分子的是________,SeO2的空间构型为________,与SeO3互为等电子体的分子和离子为________。(各写一种)
(4)氮化硼(BN)晶体有多种结构,六方相氮化硼(晶体结构如图1)是通常存在的稳定相,可作高温润滑剂,立方相氮化硼(晶体结构如图2)是超硬材料,有优异的耐磨性。
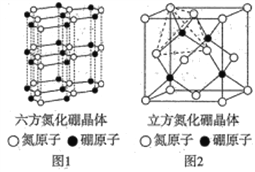
①下列关于这两种晶体的说法正确的是________ (填字母)。
a.两种晶体存在的作用力相同 b.立方氮化硼晶体可用于生产金属切割刀片
c.六方相氮化硼层间作用力小,所以质地软 d.立方相氮化硼含有σ键和π键,所以硬度大
②若图2中晶胞的边长为anm,密度为ρg·cm-3,则阿伏加德罗常数的值为________。
【答案】 1 4s24p4 N原子的2p轨道为半充满状态,具有额外的稳定性,不易失去1个电子 sp2、sp3杂化 不能 SeO3 V形 SO3、CO32- bc ![]()
【解析】(1)基态氮原子最高能级上电子的是3个P轨道电子,自旋方向相同,自旋方向有1种;基态硒原子的价层电子排布式为4s24p4;N元素第一电离能大于O元素第一电离能的原因为: N原子的2p轨道为半充满状态,具有额外的稳定性,不易失去1个电子;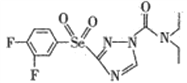 中N原子有两种杂化方式,一种是形成3个δ键,没有孤电子对,一种是形成3个δ键,1个孤电子对,故杂化方式为 sp2、sp3杂化;其分子之间不能形成氢键,没有与N、F、O相连的H原子。(3)SeO2、SeO3两种分子中,SeO3采用sp2,是平面正三角形,属于非极性分子的是SeO3;SeO2采用 sp2杂化,有一对孤电子对,分子形状为V型;与SeO3互为等电子体的分子和离子为SO3、CO32-等;(4)①a.立方相氮化硼中N原子与B原子之间形成单键,不含π键,属于原子晶体,六方相氮化硼层间作用力为范德华力,两种晶体存在的作用力不相同,故a错误; b.立方相氮化硼是超硬材料,有优异的耐磨性,属于原子晶体,立方氮化硼晶体可用于生产金属切割刀片,故b正确;c.六方相氮化硼层间作用力为范德华力,所以质地软,故c正确;d.立方相氮化硼中N原子与B原子之间形成单键,不含π键,属于原子晶体,所以硬度大,故d错误;故选bc。②若图2中晶胞的边长为anm,密度为ρg·cm-3,则阿伏加德罗常数的值为立方氮化硼中,因晶胞边长为a cm,晶胞体积V=(acm)3,该晶胞中N原子个数=8×1/8+6×1/2=4、B原子个数为4,立方氮化硼的密度=
中N原子有两种杂化方式,一种是形成3个δ键,没有孤电子对,一种是形成3个δ键,1个孤电子对,故杂化方式为 sp2、sp3杂化;其分子之间不能形成氢键,没有与N、F、O相连的H原子。(3)SeO2、SeO3两种分子中,SeO3采用sp2,是平面正三角形,属于非极性分子的是SeO3;SeO2采用 sp2杂化,有一对孤电子对,分子形状为V型;与SeO3互为等电子体的分子和离子为SO3、CO32-等;(4)①a.立方相氮化硼中N原子与B原子之间形成单键,不含π键,属于原子晶体,六方相氮化硼层间作用力为范德华力,两种晶体存在的作用力不相同,故a错误; b.立方相氮化硼是超硬材料,有优异的耐磨性,属于原子晶体,立方氮化硼晶体可用于生产金属切割刀片,故b正确;c.六方相氮化硼层间作用力为范德华力,所以质地软,故c正确;d.立方相氮化硼中N原子与B原子之间形成单键,不含π键,属于原子晶体,所以硬度大,故d错误;故选bc。②若图2中晶胞的边长为anm,密度为ρg·cm-3,则阿伏加德罗常数的值为立方氮化硼中,因晶胞边长为a cm,晶胞体积V=(acm)3,该晶胞中N原子个数=8×1/8+6×1/2=4、B原子个数为4,立方氮化硼的密度=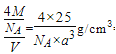 =
=![]() .
.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】250mL K2SO4和CuSO4的混合溶液中c(SO ![]() )=0.5molL﹣1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12 L气体(标准状况下).假定电解后溶液体积仍为250mL,下列说法不正确的是( )
)=0.5molL﹣1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12 L气体(标准状况下).假定电解后溶液体积仍为250mL,下列说法不正确的是( )
A.电解得到Cu的质量为3.2 g
B.上述电解过程中共转移电子0.2 mol
C.电解后的溶液中c(H+)=0.2 molL﹣1
D.原混合溶液中c(K+)=0.6 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙[ Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝
酸钙,实验装置如图所示(夹持装置略去)。
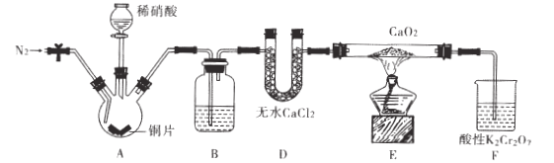
已知:![]()
请回答下列问题:
(1)向三颈烧瓶中加入稀硝酸之前,应向装置中通入一段时间的N2,原因是____。
(2)仪器D的名称是_;B中盛放的试剂是____。
(3)装置F中,酸性K2Cr2O7溶液可将剩余的NO氧化成NO3-,溶液由橙色变为绿色
(Cr3+),发生反应的离子方程式是____。
(4)已知Ca(NO2)2溶液需保持弱碱性,因为其遇酸会发生反应,产生NO气体。设计
实验证明E中有亚硝酸钙生成____。
(5)工业上可用石灰乳和硝酸工业的尾气(含NO、N02)反应,既能净化尾气,又能获得
应用广泛的Ca(NO2)2,反应原理为Ca(OH)2+NO +N02=Ca(N02)2+H2O。
①若n( NO):n(NO2)>l:l,则会导致 :
②若n( NO):n( NO2)<l l,则会导致 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是一种常用的净水剂,某化学小组同学用如下装置制备无水FeCl3。已知无水FeCl3在空气中易潮解,加热易升华。请回答下列问题:
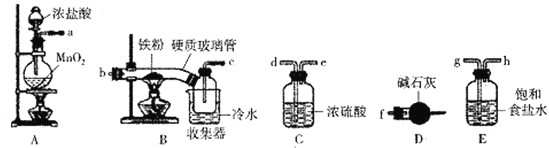
(1)装置A中发生的离子反应方程式为_______________________________。
(2)装置接口的连接顺序为____________ (用a、b、c……h表示)。
(3)装置B中收集器放在冷水中的作用为______________________。
(4)反应结束后,该小组同学对装置B中硬质玻璃管的右端进行加热,其目的是_________________。
(5)反应结束后,该小组同学将装置B中的残留物投入到足量盐酸中溶解.对所得溶液进行如下实验研究,请完成下表实验设计(药品自选)。
实验步骤 | 实验现象 | 实验结论 |
①取少许上述溶液,加入KSCN溶液 | ______ | 含有Fe3+ |
②取少许上述溶液,加入______ | 紫色溶液逐渐变浅至褪色 | _____ |
(6)工业上可用5.0mol·L-1的FeCl3溶液吸收H2S气体,若要吸收170gH2S气体;则需要该FeCl3溶液的体积为____________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值.下列说法正确的是( )
A.1L 0.1mol?L﹣1的NaHCO3溶液中HCO ![]() 和CO
和CO ![]() 离子数之和为0.1NA
离子数之和为0.1NA
B.50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
C.过氧化钠与CO2反应时,生成0.1mol氧气转移的电子数为0.2NA
D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示.下列说法错误的是( ) 
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li-Cu-空气燃料电池的原理示意如图,电池通入空气腐蚀铜电极而产生正极反应物Cu2O。下列有关说法正确的是
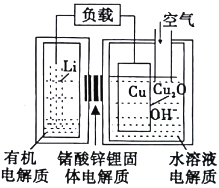
A. 电池工作时,正极上有金属锂析出
B. 电池工作时,负极区溶液中c(OH-)增大
C. 电池放电过程中的总反应为:2Cu+2Li++2OH-=2Li+Cu2O+H2O
D. 停止通入空气一段时间,电池将停止放电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是
A. 用规格为10mL的量筒量取6mL的液体
B. 用药匙或者纸槽把粉末状药品送入试管底部
C. 过滤时玻璃棒的末端应轻轻的靠在三层的滤纸上
D. 如果没有试管夹,可以临时手持试管给固体或液体加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com