
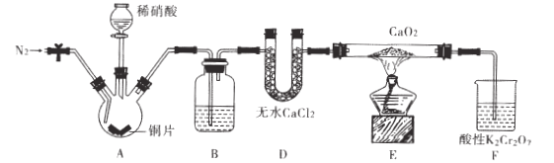
ЁОЬтФПЁПбЧЯѕЫсИЦ[ Ca(NO2)2]ЪЧЫЎФрЛьФ§ЭСЭтМгМСЕФжївЊдСЯЃЌФГбЇЯАаЁзщЩшМЦЪЕбщжЦБИбЧЯѕ
ЫсИЦЃЌЪЕбщзАжУШчЭМЫљЪОЃЈМаГжзАжУТдШЅЃЉЁЃ
вбжЊЃК![]()
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЯђШ§ОБЩеЦПжаМгШыЯЁЯѕЫсжЎЧАЃЌгІЯђзАжУжаЭЈШывЛЖЮЪБМфЕФN2ЃЌдвђЪЧ____ЁЃ
ЃЈ2ЃЉвЧЦїDЕФУћГЦЪЧ_;BжаЪЂЗХЕФЪдМСЪЧ____ЁЃ
ЃЈ3ЃЉзАжУFжаЃЌЫсадK2Cr2O7ШмвКПЩНЋЪЃгрЕФNOбѕЛЏГЩNO3-ЃЌШмвКгЩГШЩЋБфЮЊТЬЩЋ
(Cr3+)ЃЌЗЂЩњЗДгІЕФРызгЗНГЬЪНЪЧ____ЁЃ
ЃЈ4ЃЉвбжЊCa(NO2)2ШмвКашБЃГжШѕМюадЃЌвђЮЊЦфгіЫсЛсЗЂЩњЗДгІЃЌВњЩњNOЦјЬхЁЃЩшМЦ
ЪЕбщжЄУїEжагабЧЯѕЫсИЦЩњГЩ____ЁЃ
ЃЈ5ЃЉЙЄвЕЩЯПЩгУЪЏЛвШщКЭЯѕЫсЙЄвЕЕФЮВЦјЃЈКЌNOЁЂN02ЃЉЗДгІЃЌМШФмОЛЛЏЮВЦјЃЌгжФмЛёЕУ
гІгУЙуЗКЕФCa(NO2)2ЃЌЗДгІдРэЮЊCa(OH)2+NO +N02=Ca(N02)2+H2OЁЃ
ЂйШєn( NO)ЃКn(NO2ЃЉ>l:lЃЌдђЛсЕМжТ ЃК
ЂкШєn( NO)ЃКn( NO2)<l lЃЌдђЛсЕМжТ ЁЃ
ЁОД№АИЁПЃЈ1ЃЉХХГ§зАжУжаЕФO2ЃЌЗРжЙЦфЩњГЩЕФNOбѕЛЏЮЊNO2ЃЛЃЈ2ЃЉUаЮИЩдяЙмЃЌеєСѓЫЎЃЛЃЈ3ЃЉ![]() ЃЛЃЈ4ЃЉШЁЩйСПEжаЗДгІКѓЕФЙЬЬхгкЪдЙмжаЃЌЕЮМгЩйСПЯЁСђЫсЃЌЪдЙмПкгаКьзиЩЋЦјЬхЩњГЩЃЛЃЈ5ЃЉЂйХХЗХЦјЬхжаNOКЌСПЩ§ИпЃЌЮлШОЛЗОГЃЛЂкВњЦЗжаCa(NO3)2дгжЪКЌСПЩ§Ип.
ЃЛЃЈ4ЃЉШЁЩйСПEжаЗДгІКѓЕФЙЬЬхгкЪдЙмжаЃЌЕЮМгЩйСПЯЁСђЫсЃЌЪдЙмПкгаКьзиЩЋЦјЬхЩњГЩЃЛЃЈ5ЃЉЂйХХЗХЦјЬхжаNOКЌСПЩ§ИпЃЌЮлШОЛЗОГЃЛЂкВњЦЗжаCa(NO3)2дгжЪКЌСПЩ§Ип.
ЁОНтЮіЁПЪдЬтЗжЮіЃКЃЈ1ЃЉШ§ОБЩеЦПжаЪЧЭЦЌКЭЯЁСђЫсЗДгІЩњГЩNOЃЌNOШнвзБЛПеЦјжаЕФбѕЦјбѕЛЏЃЌЫљвдЯШЭЈвЛЖЮЪБМфЕФN2ЪЧЮЊСЫИЯзпзАжУжаЕФO2ЃЌЃЌД№АИЮЊЃКХХГ§зАжУжаЕФO2ЃЌЗРжЙЦфЩњГЩЕФNOбѕЛЏЮЊNO2ЃЛЃЈ2ЃЉDЪЧUаЮИЩдяЙмЃЌAжажЦШЁЕФNOПЩФмКЌгаЕФдгжЪЦјЬхЪЧNO2ЃЌЫљвдBжаЪЂЗХеєСѓЫЎПЩвдГіШЅNOжаЕФNO2ЃЌД№АИЮЊЃКUаЮИЩдяЙмЃЌеєСѓЫЎЃЛЃЈ3ЃЉзАжУFжаЃЌЫсадK2Cr2O7ШмвКПЩНЋЪЃгрЕФNOбѕЛЏГЩNO3-ЃЌШмвКгЩГШЩЋБфЮЊТЬЩЋ(Cr3+)ЃЌИљОнЕчКЩЪиКуЁЂдЊЫиЪиКуХфЦНЗНГЬЪНЃЌЗНГЬЪНЮЊЃК![]() ЃЌД№АИЮЊЃК
ЃЌД№АИЮЊЃК![]() ЃЛЃЈ4ЃЉCa(NO2)2ШмвКашБЃГжШѕМюадЃЌвђЮЊЦфгіЫсЛсЗЂЩњЗДгІЃЌВњЩњNOЦјЬхЃЌЩњГЩЕФNOдкгыПеЦјжаЕФбѕЦјЗДгІЕУЕНКьзиЩЋЦјЬхNO2ЃЌД№АИЮЊЃКЃЈ4ЃЉШЁЩйСПEжаЗДгІКѓЕФЙЬЬхгкЪдЙмжаЃЌЕЮМгЩйСПЯЁСђЫсЃЌЪдЙмПкгаКьзиЩЋЦјЬхЩњГЩЃЛЃЈ5ЃЉЙЄвЕЩЯгУЪЏЛвШщКЭЯѕЫсЙЄвЕЕФЮВЦјЃЈКЌNOЁЂN02ЃЉЗДгІЃЌМШФмОЛЛЏЮВЦјЃЌгжФмЛёЕУгІгУЙуЗКЕФCa(NO2)2ЃЌЗДгІдРэЮЊCa(OH)2+NO +N02=Ca(N02)2+H2OЁЃЂйШєn( NO)ЃКn(NO2ЃЉ>l:lЃЌNOЙ§СПЃЌЛсЕМжТNOЗДгІВЛЭъШЋЃЌХХЗХЕНПеЦјжаЮлШОЛЗОГЃЌД№АИЮЊЃКХХЗХЦјЬхжаNOКЌСПЩ§ИпЃЌЮлШОЛЗОГЃЛЂкШєn( NO)ЃКn( NO2)<l lЃЌдђЛсЗЂЩњИБЗДгІВњЩњCa(NO3)2ЃЌД№АИЮЊЃКВњЦЗжаCa(NO3)2дгжЪКЌСПЩ§Ип.
ЃЛЃЈ4ЃЉCa(NO2)2ШмвКашБЃГжШѕМюадЃЌвђЮЊЦфгіЫсЛсЗЂЩњЗДгІЃЌВњЩњNOЦјЬхЃЌЩњГЩЕФNOдкгыПеЦјжаЕФбѕЦјЗДгІЕУЕНКьзиЩЋЦјЬхNO2ЃЌД№АИЮЊЃКЃЈ4ЃЉШЁЩйСПEжаЗДгІКѓЕФЙЬЬхгкЪдЙмжаЃЌЕЮМгЩйСПЯЁСђЫсЃЌЪдЙмПкгаКьзиЩЋЦјЬхЩњГЩЃЛЃЈ5ЃЉЙЄвЕЩЯгУЪЏЛвШщКЭЯѕЫсЙЄвЕЕФЮВЦјЃЈКЌNOЁЂN02ЃЉЗДгІЃЌМШФмОЛЛЏЮВЦјЃЌгжФмЛёЕУгІгУЙуЗКЕФCa(NO2)2ЃЌЗДгІдРэЮЊCa(OH)2+NO +N02=Ca(N02)2+H2OЁЃЂйШєn( NO)ЃКn(NO2ЃЉ>l:lЃЌNOЙ§СПЃЌЛсЕМжТNOЗДгІВЛЭъШЋЃЌХХЗХЕНПеЦјжаЮлШОЛЗОГЃЌД№АИЮЊЃКХХЗХЦјЬхжаNOКЌСПЩ§ИпЃЌЮлШОЛЗОГЃЛЂкШєn( NO)ЃКn( NO2)<l lЃЌдђЛсЗЂЩњИБЗДгІВњЩњCa(NO3)2ЃЌД№АИЮЊЃКВњЦЗжаCa(NO3)2дгжЪКЌСПЩ§Ип.


 вЛЯпУћЪІЬсгХЪдОэЯЕСаД№АИ
вЛЯпУћЪІЬсгХЪдОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГУмБеШнЦїжаГфШыЕШЮяжЪЕФСПЕФAКЭBЃЌвЛЖЈЮТЖШЯТЗЂЩњЗДгІAЃЈgЃЉ+xBЃЈgЃЉ2CЃЈgЃЉЃЌДяЕНЦНКтКѓЃЌдкВЛЭЌЕФЪБМфЖЮЃЌЗжБ№ИФБфгАЯьЗДгІЕФвЛИіЬѕМўЃЌВтЕУШнЦїжаЮяжЪЕФЮяжЪЕФСПХЈЖШЁЂЗДгІЫйТЪЗжБ№ЫцЪБМфЕФБфЛЏШчЭМЫљЪОЃКЯТСаЫЕЗЈжае§ШЗЕФЪЧЃЈ ЃЉ 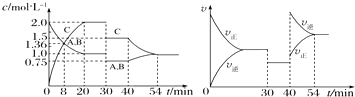
A.30ЁЋ40 minМфИУЗДгІЪЙгУСЫДпЛЏМС
B.ЗДгІЗНГЬЪНжаЕФx=1ЃЌе§ЗДгІЮЊЮќШШЗДгІ
C.30 minЪБНЕЕЭЮТЖШЃЌ40 minЪБЩ§ИпЮТЖШ
D.8 minЧАAЕФЗДгІЫйТЪЮЊ0.08 molLЉ1minЉ1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПМзДММШЪЧживЊЕФЛЏЙЄдСЯЃЌгжПЩзїЮЊШМСЯЃЎРћгУКЯГЩЦјЃЈжївЊГЩЗжЮЊCOЁЂCO2КЭH2ЃЉдкДпЛЏМСЕФзїгУЯТКЯГЩМзДМЃЌЗЂЩњЕФжївЊЗДгІШчЯТЃК
ЂйCOЃЈgЃЉ+2H2ЃЈgЃЉ![]() CH3OHЃЈgЃЉ ІЄH1
CH3OHЃЈgЃЉ ІЄH1
ЂкCO2ЃЈgЃЉ+3H2ЃЈgЃЉ![]() CH3OHЃЈgЃЉ+H2OЃЈgЃЉ ІЄH2
CH3OHЃЈgЃЉ+H2OЃЈgЃЉ ІЄH2
ЂлCO2ЃЈgЃЉ+H2ЃЈgЃЉ![]() COЃЈgЃЉ+H2OЃЈgЃЉ ІЄH3
COЃЈgЃЉ+H2OЃЈgЃЉ ІЄH3
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉвбжЊЗДгІЂйжаЕФЯрЙиЕФЛЏбЇМќМќФмЪ§ОнШчЯТЃК
ЛЏбЇМќ | HЉH | CЉO | CЁдO | HЉO | CЉH |
E/( kJmol-1) | 436 | 343 | 1076 | 465 | 413 |
гЩДЫМЦЫуІЄH1=______ЁЃвбжЊІЄH2=Љ58 kJmol-1ЃЌдђІЄH3=______ЁЃ
ЃЈ2ЃЉКЯГЩЦјжаЕФЧтЦјЪЧЗЂеЙжаЕФаТФмдДЃЌЫќЕФРћгУАќРЈжЦБИЁЂДЂДцКЭгІгУШ§ИіЛЗНкЁЃгыЦћгЭЯрБШЃЌЧтЦјзїЮЊШМСЯЕФгХЕуЪЧ__________________________________________________________ЃЈаДГіСНЕуЃЉЃЌШБЕуЪЧ______________________________________________________________________ЃЈаДГіСНЕуЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбЬЦј(жївЊЮлШОЮяSO2ЁЂNOx)ОO3дЄДІРэКѓгУCaSO3ЫЎаќИЁвКЮќЪеЃЌПЩМѕЩйбЬЦјжаSO2ЁЂNOxЕФКЌСПЁЃO3бѕЛЏбЬЦјжаSO2ЁЂNOxЕФжївЊЗДгІЕФШШЛЏбЇЗНГЬЪНЮЊЃКNO(g)ЃЋO3(g)=NO2(g)ЃЋO2(g) ЁїH=Ѓ200ЃЎ9kJЁЄmolЃ1 NO(g)ЃЋ1/2O2(g)=NO2(g) ЁїH=Ѓ58ЃЎ2kJЁЄmolЃ1 SO2(g)ЃЋO3(g)=SO3(g)ЃЋO2(g) ЁїH=Ѓ241ЃЎ6kJЁЄmolЃ1
ЃЈ1ЃЉЗДгІ3NO(g)ЃЋO3(g)=3NO2(g)ЕФЁїH=_______molЁЄLЃ1ЁЃ
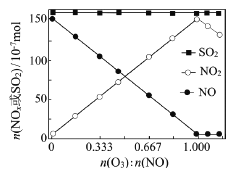
ЃЈ2ЃЉЪвЮТЯТЃЌЙЬЖЈНјШыЗДгІЦїЕФNOЁЂSO2ЕФЮяжЪЕФСПЃЌИФБфМгШыO3ЕФЮяжЪЕФСПЃЌЗДгІвЛЖЮЪБМфКѓЬхЯЕжаn(NO)ЁЂn(NO2)КЭn(SO2)ЫцЗДгІЧАn(O3)ЃКn(NO)ЕФБфЛЏМћгвЭМЁЃ
ЂйЕБn(O3)ЃКn(NO)>1ЪБЃЌЗДгІКѓNO2ЕФЮяжЪЕФСПМѕЩйЃЌЦфдвђЪЧ_________________
ЂкдіМгn(O3)ЃЌO3бѕЛЏSO2ЕФЗДгІМИКѕВЛЪмгАЯьЃЌЦфПЩФмдвђЪЧ___________________ЁЃ
ЃЈ3ЃЉЕБгУCaSO3ЫЎаќИЁвКЮќЪеОO3дЄДІРэЕФбЬЦјЪБЃЌШмвК(pHдМЮЊ 8)жаSO32ЃНЋNO2зЊЛЏЮЊNO2ЃЃЌЦфРызгЗНГЬЪНЮЊЃК_________________________________________________________________________________
ЃЈ4ЃЉCaSO3ЫЎаќИЁвКжаМгШыNa2SO4ШмвКЃЌДяЕНЦНКтКѓШмвКжаc(SO32Ѓ)=_____________________________[гУc(SO42Ѓ)ЁЂKsp(CaSO3)КЭKsp(CaSO4)БэЪО]ЃЛCaSO3ЫЎаќИЁвКжаМгШыNa2SO4ШмвКФмЬсИпNO2ЕФЮќЪеЫйТЪЃЌЦфжївЊдвђЪЧ__________________________________________________________________
ЃЈ5ЃЉМзДМШМСЯЕчГидкМюадШмвКжаЕФЕчМЋЗДгІЪНЁЃе§МЋ_________________________________ЃЛИКМЋ____________________________________________________________________________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗДгІЕФРызгЗНГЬЪНЪщаДе§ШЗЕФЪЧ(ЁЁЁЁ)
A. ТШЛЏТСШмвКжаМгШыЙ§СПАБЫЎЃКAl3++4NH3ЁЄH2O![]() AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
B. ГЮЧхЪЏЛвЫЎгыЩйСПЫеДђШмвКЛьКЯЃКCa2++OH-+HCO3-![]() CaCO3Ё§+H2O
CaCO3Ё§+H2O
C. ЬМЫсИЦШмгкДзЫсЃКCaCO3+2H+![]() Ca2++CO2Ёќ+H2O
Ca2++CO2Ёќ+H2O
D. ТШЛЏбЧЬњШмвКжаЭЈШыТШЦјЃК2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЫцзХЩњЛюЫЎЦНЕФЬсИпЃЌШЫУЧдНРДдНжиЪгЁАТЬЩЋЪГЦЗЁБЃЌТЬЩЋЪГЦЗЪЧжИ(ЁЁЁЁ)
A.ЬэМгСЫТЬЩЋЩЋЫиЕФЪГЦЗ
B.КЌгавЖТЬЫиЕФЪГЦЗ
C.дСЯЩњВњЙ§ГЬжаУЛгаЪЙгУЛЏЗЪЁЂХЉвЉЕФЪГЦЗ
D.дСЯЩњВњМАМгЙЄЙ§ГЬжаУЛгаЪмЕНЮлШОЕФЪГЦЗ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГбЇЩњгћгУвбжЊЮяжЪЕФСПХЈЖШЮЊ0.1000mol/LЕФNaOHШмвКРДВтЖЈЮДжЊЮяжЪЕФСПХЈЖШЕФбЮЫсЃЌбЁдёЗгЬЊзїжИЪОМСЃЎЧыЬюаДЯТСаПеАзЃК![]()
ЃЈ1ЃЉШчЭМвЧЦїЕФУћГЦЪЧ ЃЎ
ЃЈ2ЃЉгУБъзМЕФЧтбѕЛЏФЦШмвКЕЮЖЈД§ВтЕФбЮЫсЪБЃЌзѓЪжМЗбЙЯ№ЦЄЙмжаВЃСЇаЁЧђЃЌгвЪжвЁЖЏзЖаЮЦПЃЌблОІзЂЪг ЃЌ ЕЮЖЈжеЕуЕФХаЖЯЗНЗЈЪЧ ЃЎ
ЃЈ3ЃЉИљОнЯТУцБэИёЪ§ОнЃЌПЩМЦЫуГіИУбЮЫсЕФХЈЖШдМЮЊЃЈБЃСєСНЮЛгааЇЪ§зжЃЉЃЎ
ЪЕбщ | NaOHШмвКЕФ | ЕЮЖЈЭъГЩЪБЃЌШмвКЕЮШыЕФЬхЛ§/mL aOH | Д§ВтбЮЕФЬхЛ§/mLЫс |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
ЃЈ4ЃЉдкЩЯЪіЪЕбщжаЃЌЯТСаВйзїЃЈЦфЫћВйзїе§ШЗЃЉЛсдьГЩВтЖЈНсЙћЦЋИпЕФга ЃЎ
A.ЕЮЖЈжеЕуЖСЪ§ЪБИЉЪгЖСЪ§
B.ЫсЪНЕЮЖЈЙмЪЙгУЧАЃЌЫЎЯДКѓЮДгУД§ВтбЮЫсЁЂШѓЯД
C.зЖаЮЦПЫЎЯДКѓЮДИЩдя
D.МюЪНЕЮЖЈЙмМтзьВПЗжгаЦјХнЃЌЕЮЖЈКѓЯћЪЇЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПHЁЂCЁЂNЁЂOЁЂFЁЂSeЪЧСљжжживЊЕФЗЧН№ЪєдЊЫиЁЃЧыИљОнЫљбЇЕФЮяжЪНсЙЙгыаджЪЕФЯрЙижЊЪЖЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЛљЬЌЕЊдзгзюИпФмМЖЩЯЕчзгЕФзда§ЗНЯђга________жж,ЛљЬЌЮјдзгЕФМлВуЕчзгХХВМЪНЮЊ________ЃЌNдЊЫиЕквЛЕчРыФмДѓгкOдЊЫиЕквЛЕчРыФмЕФдвђЮЊ____________ЁЃ
ЃЈ2ЃЉФГИпаЇЕЭЖОЕФаТаЭХЉвЉЕФНсЙЙМђЪНЮЊ ,дђИУЮяжЪжаЕЊдзгЕФдгЛЏЙьЕРРраЭЮЊ________,ЦфЗжзгжЎМф________ЃЈЬюЁАФмЁБЛђЁАВЛФмЁБЃЉаЮГЩЧтМќЁЃ
,дђИУЮяжЪжаЕЊдзгЕФдгЛЏЙьЕРРраЭЮЊ________,ЦфЗжзгжЎМф________ЃЈЬюЁАФмЁБЛђЁАВЛФмЁБЃЉаЮГЩЧтМќЁЃ
ЃЈ3ЃЉSeO2ЁЂSeO2СНжжЗжзгжа,ЪєгкЗЧМЋадЗжзгЕФЪЧ________,SeO2ЕФПеМфЙЙаЭЮЊ________,гыSeO3ЛЅЮЊЕШЕчзгЬхЕФЗжзгКЭРызгЮЊ________ЁЃЃЈИїаДвЛжжЃЉ
ЃЈ4ЃЉЕЊЛЏХ№ЃЈBNЃЉОЇЬхгаЖржжНсЙЙ,СљЗНЯрЕЊЛЏХ№ЃЈОЇЬхНсЙЙШчЭМ1ЃЉЪЧЭЈГЃДцдкЕФЮШЖЈЯр,ПЩзїИпЮТШѓЛЌМС,СЂЗНЯрЕЊЛЏХ№ЃЈОЇЬхНсЙЙШчЭМ2ЃЉЪЧГЌгВВФСЯ,гагХвьЕФФЭФЅадЁЃ
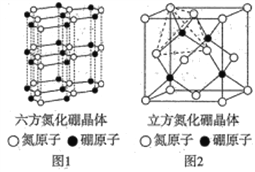
ЂйЯТСаЙигкетСНжжОЇЬхЕФЫЕЗЈе§ШЗЕФЪЧ________ ЃЈЬюзжФИЃЉЁЃ
aЃЎСНжжОЇЬхДцдкЕФзїгУСІЯрЭЌ bЃЎСЂЗНЕЊЛЏХ№ОЇЬхПЩгУгкЩњВњН№ЪєЧаИюЕЖЦЌ
cЃЎСљЗНЯрЕЊЛЏХ№ВуМфзїгУСІаЁ,ЫљвджЪЕиШэ dЃЎСЂЗНЯрЕЊЛЏХ№КЌгаІвМќКЭІаМќ,ЫљвдгВЖШДѓ
ЂкШєЭМ2жаОЇАћЕФБпГЄЮЊanm,УмЖШЮЊІбgЁЄcm-3,дђАЂЗќМгЕТТоГЃЪ§ЕФжЕЮЊ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаБфЛЏжаЃЌашвЊМгШыбѕЛЏМСЕФЪЧ
AЃЎHClЁњ H2 BЃЎHCl ЁњFeCl2
CЁЂH2SO4ЃЈХЈЃЉЁњSO2 DЃЎFeЁњFe2O3
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com