
【题目】甲醇既是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H﹣H | C﹣O | C≡O | H﹣O | C﹣H |
E/( kJmol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=______。已知ΔH2=﹣58 kJmol-1,则ΔH3=______。
(2)合成气中的氢气是发展中的新能源,它的利用包括制备、储存和应用三个环节。与汽油相比,氢气作为燃料的优点是__________________________________________________________(写出两点),缺点是______________________________________________________________________(写出两点)。
【答案】 -99 kJmol-1 +41 kJmol-1 资源丰富,可再生;燃烧热值高;产物无毒、无污染 氢气的储存和运输困难;以水为原料获得廉价、丰富的氢能技术还有待突破。
【解析】(1)因为反应热=反应物的总键能-生成物的总键能,所以ΔH1=1076kJmol-1+2×436kJmol-1-3×413 kJmol-1-343 kJmol-1-465 kJmol-1=-99 kJmol-1;根据盖斯定律,②-①得反应③,则ΔH3=-58kJmol-1+99kJmol-1=+41kJmol-1。
(2)氢气作为能源具有其它能源所不具备的优点:①可以用广泛存在的水作原料来制取;②燃烧热值高,放出的热量约为同质量汽油的三倍;③最大的优点是它燃烧后的产物是水,不污染环境。综上分析,与汽油相比,氢气作为燃料的优点有:污染小、可再生、来源广、资源丰富、燃烧热值高等。发展氢能源需要解决如何廉价地大量制备氢气,以及如何安全贮存、运输氢气等问题,世界各地的科学家正在致力于这方面的研究。综上分析,与汽油相比,氢气作为燃料的缺点是:氢气的储存和运输困难;以水为原料获得廉价、丰富的氢能技术还有待突破。


科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素。下列判断正确的是

A. 甲一定是金属元素
B. 气态氢化物的稳定性:庚>己>戊
C. 乙、丙、丁的最高价氧化物水化物可以以相互反应
D. 庚的最高价氧化物水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】截至到2013年12月末,中国光伏发电新增装机容量达到10.66GW,光伏发电累计装机容量达到17.16GW。下列左图为光伏并网发电装置,右图为电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。下列叙述中正确的是
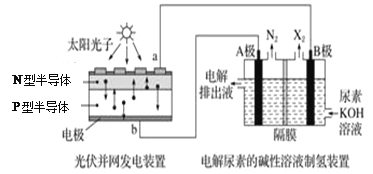
A. 左图中N型半导体为正极,P型半导体为负极
B. 右图溶液中电子流向为从B极流出,从A极流入
C. X2为氧气
D. 工作时,A极的电极反应式为CO(NH2)2+8OH-﹣6e-=CO32-+N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】250mL K2SO4和CuSO4的混合溶液中c(SO ![]() )=0.5molL﹣1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12 L气体(标准状况下).假定电解后溶液体积仍为250mL,下列说法不正确的是( )
)=0.5molL﹣1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12 L气体(标准状况下).假定电解后溶液体积仍为250mL,下列说法不正确的是( )
A.电解得到Cu的质量为3.2 g
B.上述电解过程中共转移电子0.2 mol
C.电解后的溶液中c(H+)=0.2 molL﹣1
D.原混合溶液中c(K+)=0.6 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是生活中的一种常见金属,用途非常广泛。
(1)FeCl3溶液用于腐蚀铜制印刷电路板,发生反应的离子方程式为___________。
(2)废铁皮制取铁红粉的局部流程图如下:
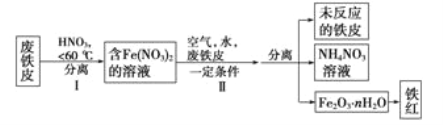
①步骤1温度不能太高的原因是____________________________。
②步骤Ⅱ中发生反应:
4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3
4Fe+10HNO3==4Fe( NO3)2+NH4NO3+3H20
第一个反应的氧化剂是___________,氧化产物是____________。第二个反应每生成1 molNH4NO3,转移的电子数是_________。
③铁红可用于焊接钢轨,其反应的化学方程式为_______________。
④上述生产结束后,流程中氮元素最主要的存在形式为__________(填字母)。
A.氮氧化物 B.硝酸铵 C.硝酸亚铁 D.硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存.
(1)一定温度下,向1L 0.1molL﹣1CH3COOH溶液中加入0.1mol CH3COONa固体,溶液中 ![]() (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 .
(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 .
(2)常温下向20mL 0.1molL﹣1Na2CO3溶液中逐滴加入0.1molL﹣1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:回答下列问题: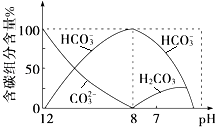
①在同一溶液中,H2CO3、HCO ![]() 、CO
、CO ![]() (填“能”或“不能”)大量共存;
(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有、 , 溶液中含量最多的三种微粒的物质的量浓度的大小关系为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙[ Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝
酸钙,实验装置如图所示(夹持装置略去)。
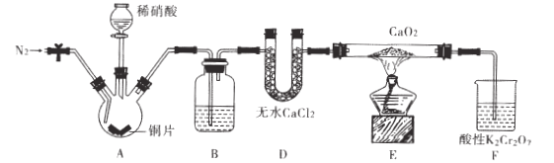
已知:![]()
请回答下列问题:
(1)向三颈烧瓶中加入稀硝酸之前,应向装置中通入一段时间的N2,原因是____。
(2)仪器D的名称是_;B中盛放的试剂是____。
(3)装置F中,酸性K2Cr2O7溶液可将剩余的NO氧化成NO3-,溶液由橙色变为绿色
(Cr3+),发生反应的离子方程式是____。
(4)已知Ca(NO2)2溶液需保持弱碱性,因为其遇酸会发生反应,产生NO气体。设计
实验证明E中有亚硝酸钙生成____。
(5)工业上可用石灰乳和硝酸工业的尾气(含NO、N02)反应,既能净化尾气,又能获得
应用广泛的Ca(NO2)2,反应原理为Ca(OH)2+NO +N02=Ca(N02)2+H2O。
①若n( NO):n(NO2)>l:l,则会导致 :
②若n( NO):n( NO2)<l l,则会导致 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示.下列说法错误的是( ) 
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com