
【题目】一定稳定下,在容积不变的密闭容器中,进行如下可逆反应:![]() ,下列能表明该反应已达到平衡状态的是
,下列能表明该反应已达到平衡状态的是
①![]()
②![]()
③![]()
④混合气的密度保持不变
⑤混合气体的平均摩尔质量不变
A.仅④B.仅④⑤
C.仅①④D.仅③④⑤
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】工业生产硝酸的尾气中含有氮氧化物NOx(假设仅为NO和NO2的混合物),影响生态环境。
Ⅰ.氮氧化物NOx 对环境主要影响有两点____、____。
Ⅱ.工业上可用氨催化吸收法处理NOx ,反应原理为:NH3 + NOx![]() N2 + H2O
N2 + H2O
某化学兴趣小组模拟该处理过程的实验装置如下:

(1)装置A中发生反应的化学方程式为________。
(2)装置C的作用有两个:一个作用是通过气泡产生的速率来控制反应物的比例,另一个作用是______。装置F的作用是_______。
(3)反应6 NO2+8 NH3![]() 7 N2+12 H2O可用于处理NO2。当转移3.6 mol电子时,消耗NO2的物质的量为_______mol。
7 N2+12 H2O可用于处理NO2。当转移3.6 mol电子时,消耗NO2的物质的量为_______mol。
Ⅲ.工业上也常用NaOH溶液吸收法处理NOx :
NO + NO2 + 2NaOH= 2NaNO2 + H2O (I)
2NO2 + 2NaOH =NaNO2 + NaNO3 + H2O (II)
(1)当NOx被NaOH溶液完全吸收时,转化为盐。x的值可能是_____(填字母)。
A.1.0 B.1.3 C.1.5 D.2.0
(2)2240 mL(标准状况)NO 和NO2的混合气体溶于200 mL NaOH溶液中,恰好完全反应,并无气体放出,则NaOH溶液物质的量浓度是__________。
Ⅳ.除能防止有毒气体的污染外,NaOH溶液吸收法还具有的优点是_____,其缺点是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时将10mLpH=11的氨水加水稀释至100mL,下列判断正确的是
A.稀释后溶液的pH=7B.氨水的电离度增大,溶液中所有离子的浓度均减小
C.稀释过程中![]() 增大D.pH = 11氨水的浓度为0.001mol/L
增大D.pH = 11氨水的浓度为0.001mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体a通入溶液b中(装置如图所示),始终无明显变化的是
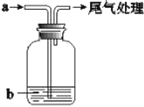
选项 | A | B | C | D |
气体a | CO2 | Cl2 | NO2 | SO2 |
溶液b | CaCl2 | KI | FeSO4 | Ba(NO3)2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-溴丁烷(密度1.2758 g/mL)是重要的有机合成中间体及有机溶剂,可以在实验室里用溴化钠、浓硫酸和1-丁醇为原料,经过如图六步制得。
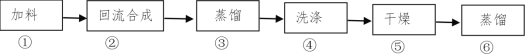
完成下列填空:
(1)通过步骤②获得粗产品,反应的化学方程式是___。此时产品往往呈红棕色,原因是____。实验室里有下列常用试剂,请根据实验需要为与步骤④相关的(2)(3)小题选择试剂,并用试剂编号填空:
a.NaOH溶液 b.NaHCO3溶液 c.NaHSO3 溶液 d.NaBr溶液
(2)产品的红棕色可用___除去(填写试剂编号),相应的离子方程式为___。
(3)选用浓硫酸洗去未反应的1-丁醇和有机副产物,然后除酸。最适宜的除酸试剂是__(填写试剂编号)。
(4)用浓硫酸(密度1.84g/mL)洗涤时,采用___(填写仪器名称)分离出___(填写“上”或“下”)层产物。
(5)检验产物中含有溴元素的实验方法是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知 W 的一种核素的质量数为 18,中子数为 10;X 和 Ne 的核外电子数相差 1; 在Z所在的周期中,Z 元素的原子得电子能力最强;四种元素的最外层电子数之和为18。 请回答下列问题:
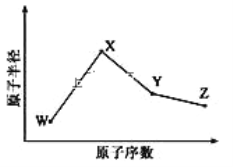
(1)X 元素位于元素周期表中位置为_____________。
(2)X 的单质和 Y 的单质相比,熔点较高的是____________(写化学式) 。 Z 所在族的简单氢化物中,沸点最高的是________(写化学式),原因为_________________________。
(3)W、X、Z 三种元素形成的化合物中化学键类型为________;X2W2的电子式为___________________。
(4)Y 与 Z 形 成的化合物在常温下是一种液态,它和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式为__________________________。
(5)Z 的氧化物很多,其中一种黄绿色气体 M,其氧含量为 47.41%,可用于水处理, M 在液态和浓缩气态时具有爆炸性 。 M 的化学式为_____________。 M 可与 NaOH 溶液反应生成两种稳定的盐,它们的物质的量之比为 1︰5,该反应的化学方程式为___________________。
(6)在 25°C、101kPa 下,已知 Y 的简单气态氢化物在氧气中完全燃烧后恢复至原状态, 平均每转移 1mol 电子放热 190kJ, 该反应的热化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Co2O3在酸性溶液中易被还原成Co2+;Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.3Cl2+2FeI2=2FeCl3+2I2B.Cl2+FeI2=FeCl2+I2
C.2Fe2++ I2=2Fe3++2I-D.Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求作答。
(1)![]() 的名称为______________.
的名称为______________.
(2)CH3CH2OH所含官能团的电子式:_____________.
(3) 进行一氯取代反应后,只能生成_________种沸点不同产物.
进行一氯取代反应后,只能生成_________种沸点不同产物.
仔细辨认以下物质,然后按要求作答:
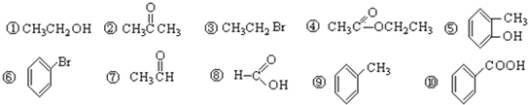
(4)属于芳香烃的__________;
(5)属于醇类的有__________;
(6)①和⑩反应的化学方程式___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究氨基甲酸铵(![]() )分解的化学平衡和水解反应速率。将一定量纯净的氨基甲酸铵置于固定容积为100mL的密闭真空溶液A中,在恒定温度下使其达到分解平衡。实验测得不同温度下的平衡数据列于下表:
)分解的化学平衡和水解反应速率。将一定量纯净的氨基甲酸铵置于固定容积为100mL的密闭真空溶液A中,在恒定温度下使其达到分解平衡。实验测得不同温度下的平衡数据列于下表:
温度(℃) | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总物质的量(mol) | 0.34 | 0.48 | 0.68 | 0.94 |
①氨基甲酸铵分解的化学方程式为![]() ,若25.0℃时达到平衡所用时间为8min,根据数据计算
,若25.0℃时达到平衡所用时间为8min,根据数据计算![]() 的平均生成速率为________________。
的平均生成速率为________________。
②可以判断该分解反应已经达到化学平衡的是_________。
A.2υ(NH3)正=υ(CO2)逆 B.密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com