
【题目】工业生产硝酸的尾气中含有氮氧化物NOx(假设仅为NO和NO2的混合物),影响生态环境。
Ⅰ.氮氧化物NOx 对环境主要影响有两点____、____。
Ⅱ.工业上可用氨催化吸收法处理NOx ,反应原理为:NH3 + NOx![]() N2 + H2O
N2 + H2O
某化学兴趣小组模拟该处理过程的实验装置如下:

(1)装置A中发生反应的化学方程式为________。
(2)装置C的作用有两个:一个作用是通过气泡产生的速率来控制反应物的比例,另一个作用是______。装置F的作用是_______。
(3)反应6 NO2+8 NH3![]() 7 N2+12 H2O可用于处理NO2。当转移3.6 mol电子时,消耗NO2的物质的量为_______mol。
7 N2+12 H2O可用于处理NO2。当转移3.6 mol电子时,消耗NO2的物质的量为_______mol。
Ⅲ.工业上也常用NaOH溶液吸收法处理NOx :
NO + NO2 + 2NaOH= 2NaNO2 + H2O (I)
2NO2 + 2NaOH =NaNO2 + NaNO3 + H2O (II)
(1)当NOx被NaOH溶液完全吸收时,转化为盐。x的值可能是_____(填字母)。
A.1.0 B.1.3 C.1.5 D.2.0
(2)2240 mL(标准状况)NO 和NO2的混合气体溶于200 mL NaOH溶液中,恰好完全反应,并无气体放出,则NaOH溶液物质的量浓度是__________。
Ⅳ.除能防止有毒气体的污染外,NaOH溶液吸收法还具有的优点是_____,其缺点是_____。
【答案】酸雨 光化学烟雾 2NH4Cl +Ca(OH)2![]() CaCl2 + 2NH3↑ + 2H2O 混合气体 尾气吸收 0.9 CD 0.5 mol/L 得到化工产品;操作简单 若NO过量,则不能被全部吸收
CaCl2 + 2NH3↑ + 2H2O 混合气体 尾气吸收 0.9 CD 0.5 mol/L 得到化工产品;操作简单 若NO过量,则不能被全部吸收
【解析】
Ⅰ.酸雨是指PH<5.6的雨水,氮氧化物NOx可形成硝酸型酸雨;光化学污染是氮的氧化物和有机烃类在光作用下的一系列复杂变化,光化学污染与氮的氧化物有关;
Ⅱ.A装置:制取氨气,B装置:制取一氧化氮,C装置:一个作用是通过气泡产生的速率来控制反应物的比例,另一个作用使氨气和一氧化氮混合均匀,c中挥发的氨气含有水蒸气,进入E加热前应进行干燥,D装置:干燥混合气体,E装置:NH3+NOx ![]() N2+H2O,F装置:用浓硫酸吸收尾气氨气;
N2+H2O,F装置:用浓硫酸吸收尾气氨气;
(1)氯化铵固体和氢氧化钙固体在加热的条件下发生反应生成氨气;
(2)混合气体通过浓氨水能进行气体均匀混合,同时通过逸出气泡数量监测反应的速率;F装置:用浓硫酸吸收尾气氨气;
(3)由方程式可知,反应中NH3→N2氮元素化合价由-3价升高为0价,每转移24mol电子消耗NO2的物质的量为6mol,据此计算转移3.6mol电子时,消耗NO2的物质的量;
Ⅲ.(1)根据反应:NO+NO2+2NaOH═2NaNO2+H2O;2NO2+2NaOH═NaNO2+NaNO3+H2O,混合气体通入NaOH溶液被完全吸收时,应满足n(NO2)≥n(NO)即可;
(2)反应产物NaNO2、NaNO3,根据Na和N原子守恒,n(NaOH)=![]() =0.1mol,带入c=
=0.1mol,带入c=![]() 计算浓度;
计算浓度;
Ⅳ.氮氧化物有毒,对环境有污染,与氨催化吸收法比较,操作简便,产物为盐,可回收作氮肥,缺点是消耗碱,不经济,且若NO过量,则不能被全部吸收。
Ⅰ.氮氧化物NOx可形成硝酸型酸雨,光化学烟雾是城市大气中的碳氢化合物(HC)和氮氧化合物(NOx)在阳光紫外线的作用下发生的一系列链式大气化学反应生成以臭氧(O3)为代表的刺激性二次污染物,氮氧化物NOx,可形成光化学烟雾;
答案为:酸雨;光化学烟雾;
Ⅱ.(1)氯化铵固体和氢氧化钙固体在加热的条件下发生反应生成氨气,所以装置A的反应是:2NH4Cl +Ca(OH)2![]() CaCl2 + 2NH3↑ + 2H2O ;
CaCl2 + 2NH3↑ + 2H2O ;
答案为2NH4Cl +Ca(OH)2![]() CaCl2 + 2NH3↑ + 2H2O 。
CaCl2 + 2NH3↑ + 2H2O 。
(2)装置C:一个作用是通过气泡产生的速率来控制反应物的比例,另一个作用使氨气和一氧化氮混合均匀;装置F作用:用浓硫酸吸收尾气氨气;
答案为使氨气和一氧化氮混合均匀;吸收尾气。
(3)由方程式可知,反应中NH3→N2氮元素化合价由-3价升高为0价,每转移24mol电子消耗NO2的物质的量为6mol,转移3.6mol电子时,消耗NO2的物质的量为![]() ×6mol=0.9mol;
×6mol=0.9mol;
答案为0.9。
Ⅲ.(1)由方程式可知混合气体通入NaOH溶液被完全吸收时,应满足n(NO2)≥n(NO),即x≥1.5,所以CD符合;
答案为CD;
(2)反应产物NaNO2、NaNO3,根据Na和N原子守恒,n(NaOH)=![]() =0.1mol,NaOH溶液物质的量浓度c=
=0.1mol,NaOH溶液物质的量浓度c=![]() =0.5mol/L;
=0.5mol/L;
故答案为0.5mol/L;
Ⅳ.氮氧化物有毒,对环境有污染,用氢氧化钠吸收氮氧化物能将有毒气体转化为无毒物质,防止有毒气体的污染,操作简便,同时产物为盐,可回收作氮肥;缺点是消耗强碱,生成盐,不经济,且若NO过量,则不能被全部吸收;
答案为操作简便,产物为盐,可回收作氮肥;不经济,且若NO过量,不能被全部吸收。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:
【题目】有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8g该有机物经燃烧生成44.0gCO2和14.4gH2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O—H键和位于分子端的—C≡C—键,核磁共振氢谱上有三个峰,峰面积之比为6∶1∶1。
(1)A的分子式是____________________________________。
(2)下列物质中,一定条件下能与A发生反应的是________。
A.H2 B.Na C.酸性KMnO4溶液 D.Br2
(3)A的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容密闭容器中存在下列平衡:![]() 。
。![]() 的平衡物质的量浓度与温度T的关系如图所示。则说法错误的是
的平衡物质的量浓度与温度T的关系如图所示。则说法错误的是
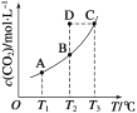
A.反应![]() 为吸热反应
为吸热反应
B.在![]() 时,若反应处于状态D,则一定有v正>v逆
时,若反应处于状态D,则一定有v正>v逆
C.平衡状态A与C相比,平衡状态A中的c(CO)大
D.若![]() 、
、![]() 时的平衡常数分别为
时的平衡常数分别为![]() ,则
,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10 mol·L-1盐酸逐滴滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH= -lg c(OH-)。下列说法正确的是( )
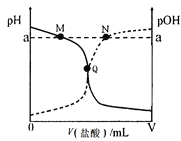
A. M点所示溶液中:c(NH4+)+c(NH3·H2O)= c(Cl-)
B. N点所示溶液中:c(NH4+)>c(Cl-)
C. Q点所示消耗盐酸的体积等于氨水的体积
D. M点和N点所示溶液中水的离子积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某微粒的结构示意图为![]() ,试回答:
,试回答:
(1)当y=8时,该粒子可能是_____、_____(分别写出一种阳离子和一种阴离子)。
(2)当x-y=10时,该粒子为_______(选填“原子”或“阳离子”、“阴离子”)。
(3)请写出工业上制取y=7元素对应单质的化学方程式:________________。
Ⅱ.现有 ①BaCl2晶体 ②金刚石 ③碘片 ④干冰 ⑤二氧化硅 ⑥氢氧化钾 ⑦钠 七种物质,请按下列要求回答(填序号):
(1)属于只含离子键的离子晶体的是____________(填序号,下同)。
(2)属于分子晶体的单质是__________。
(3)属于原子晶体的化合物是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数,下列叙述正确的是( )
A.含1mol乙酸的溶液中H+数等于0.1NA
B.标准状况下,22.4L乙醇的分子数为NA
C.28g乙烯和丙烯所含碳氢键的数目为4NA
D.1 mol甲基所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是合成二氢荆芥内酯的重要原料,其结构简式如下图,下列检验A中官能团的试剂和顺序正确的是( )

A. 先加酸性高锰酸钾溶液,后加银氨溶液,微热
B. 先加溴水,后加酸性高锰酸钾溶液
C. 先加银氨溶液,微热,再加入溴水
D. 先加入新制氢氧化铜,微热,酸化后再加溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃 R—CH2—CH2—X 中化学键如图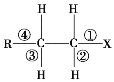 所示,则下列说法正确的是()
所示,则下列说法正确的是()
A. 发生水解反应时,被破坏的键是①和③
B. 发生消去反应时,被破坏的键是①和④
C. 发生水解反应时,被破坏的键是①
D. 发生消去反应时,被破坏的键是①和②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定稳定下,在容积不变的密闭容器中,进行如下可逆反应:![]() ,下列能表明该反应已达到平衡状态的是
,下列能表明该反应已达到平衡状态的是
①![]()
②![]()
③![]()
④混合气的密度保持不变
⑤混合气体的平均摩尔质量不变
A.仅④B.仅④⑤
C.仅①④D.仅③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com