
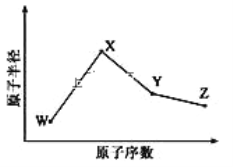
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知 W 的一种核素的质量数为 18,中子数为 10;X 和 Ne 的核外电子数相差 1; 在Z所在的周期中,Z 元素的原子得电子能力最强;四种元素的最外层电子数之和为18。 请回答下列问题:
(1)X 元素位于元素周期表中位置为_____________。
(2)X 的单质和 Y 的单质相比,熔点较高的是____________(写化学式) 。 Z 所在族的简单氢化物中,沸点最高的是________(写化学式),原因为_________________________。
(3)W、X、Z 三种元素形成的化合物中化学键类型为________;X2W2的电子式为___________________。
(4)Y 与 Z 形 成的化合物在常温下是一种液态,它和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式为__________________________。
(5)Z 的氧化物很多,其中一种黄绿色气体 M,其氧含量为 47.41%,可用于水处理, M 在液态和浓缩气态时具有爆炸性 。 M 的化学式为_____________。 M 可与 NaOH 溶液反应生成两种稳定的盐,它们的物质的量之比为 1︰5,该反应的化学方程式为___________________。
(6)在 25°C、101kPa 下,已知 Y 的简单气态氢化物在氧气中完全燃烧后恢复至原状态, 平均每转移 1mol 电子放热 190kJ, 该反应的热化学方程式为__________________________________。
【答案】.第三周期, 第IA族SiHFHF 分子间能形成氢键离子键、共价键![]() SiCl4 +3H2O=H 2SiO3 +3HClClO26ClO2+6NaOH=NaCl+5NaClO3+3H2OSiH4 (g)+2O2 (g)=SiO2 (s)+2H2O(l) ΔH=—1520kJ/mol
SiCl4 +3H2O=H 2SiO3 +3HClClO26ClO2+6NaOH=NaCl+5NaClO3+3H2OSiH4 (g)+2O2 (g)=SiO2 (s)+2H2O(l) ΔH=—1520kJ/mol
【解析】
W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,则其质子数为18-10=8,故W为O元素;X和Ne原子的核外电子数相差1,原子半径大于O,故X为Na;由原子序数可以知道,Y、Z处于第三周期, Z的吸引电子的能力在同周期主族元素中最大,则Z为Cl,四种元素的最外层电子数之和为18,则Y的最外层电子数为18-6-1-7=4,所以Y为Si。
(1)X 元素为Na元素,位于元素周期表中位置为第三周期,第IA族;
(2)金属Na的熔点较低,Si属于原子晶体,熔点很高,故Si的熔点较高;Cl位于元素周期表第ⅦA族,F的电负性强,分子间可形成氢键,故HF沸点最高;
(3)W、X、Z 三种元素形成的化合物可能为NaClO,离子化合物,其中含有离子键和共价键;X2W2为Na2O2,离子化合物,电子式为:![]() ;
;
(4)Y与Z形成的化合物为SiCl4,和足量水反应,生成一种弱酸和一种强酸,应生成H2SiO3与HCl,该反应的化学方程式是:SiCl4 +3H2O=H 2SiO3 +3HCl;
(5)Z 的氧化物很多,其中一种黄绿色气体 M,其氧含量为 47.41%,则氯的含量为52.59%设M的化学式为ClxOy,则35.5x:16y=52.59:47.41,计算得x: y=1:2,则M为ClO2;M 可与 NaOH 溶液反应生成两种稳定的盐,它们的物质的量之比为 1︰5,即NaCl 和NaClO3,则反应方程式为:6ClO2+6NaOH=NaCl+5NaClO3+3H2O;
(6)1mol SiH4完全燃烧转移的电子数为8mol,所以放热为190kJ×8=1520kJ,因此热化学方程式为SiH4 (g)+2O2 (g)=SiO2 (s)+2H2O(l) ΔH=—1520kJ/mol。


科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数,下列叙述正确的是( )
A.含1mol乙酸的溶液中H+数等于0.1NA
B.标准状况下,22.4L乙醇的分子数为NA
C.28g乙烯和丙烯所含碳氢键的数目为4NA
D.1 mol甲基所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大。A、E元素的原子最外层均只有一个电子,且A和E可形成离子化合物;B是组成有机化合物的核心元素;C的单质是空气中含量最多的气体;D原子的最外层电子数是其内层电子数的3倍;F和D同主族。请回答:
(1)A、D、E组成的化合物的电子式为_____。
(2)B元素在周期表中的位置是__,由它组成的一种同素异形体属于原子晶体,其名称为___。
(3)C、D的简单氢化物中热稳定性较强的物质的化学式为____。
(4)E、F的最高价氧化物对应的水化物之间反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是
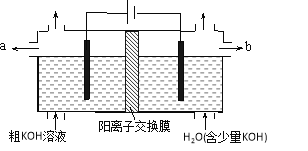
A. 通电后阴极区附近溶液pH会增大
B. 阳极反应式为4OH--4e-=2H2O+O2↑
C. 纯净的KOH溶液从b出口导出
D. K+通过交换膜从阴极区移向阳极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定稳定下,在容积不变的密闭容器中,进行如下可逆反应:![]() ,下列能表明该反应已达到平衡状态的是
,下列能表明该反应已达到平衡状态的是
①![]()
②![]()
③![]()
④混合气的密度保持不变
⑤混合气体的平均摩尔质量不变
A.仅④B.仅④⑤
C.仅①④D.仅③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g)![]() N2(g)+CO2(g)。在2L恒容密闭容器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
N2(g)+CO2(g)。在2L恒容密闭容器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
(1)写出上述反应的平衡常数表达式______。
(2)①结合表中数据,判断该反应的ΔH____0(填“>”或“<”),理由是_____
②判断该反应达到平衡的依据是_____。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)=v逆(N2)
II.结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 |
HClO | 3×10-8 |
H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
H2C2O4 | K1=5.4×10-2 K2=5.4×10-5 |
| <>H2S | K1=1.3×10-7 K2=7.1×10-15 |
请回答下列问题:
(1)同浓度的CH3COO-、![]() 、
、![]() 、
、![]() 、ClO-、S2-中结合H+的能力最弱的是____。
、ClO-、S2-中结合H+的能力最弱的是____。
(2)常温下0.1mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___(填字母)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)/c(OH-) D.c(OH-)
(3)0.1mol·L-1的H2C2O4溶液与0.1mol·L-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为_____。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK___NaClO,两溶液中:c(Na+)-c(ClO-)___c(K+)-c(CH3COO-)(填“>”“<”或“=”)。
(5)向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )

A. 由红外光谱可知,该有机物中至少有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D. 若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于合成氨反应N2(g)+3H2(g) ![]() 2NH3(g) H<0;,下列反应速率关系中,正确的是
2NH3(g) H<0;,下列反应速率关系中,正确的是
A.3 v (N2)=v(H2) B.v (N2)=3v(H2)
C.1.5v (H2)=v(NH3) D.v (N2)=2v(NH3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com