
【题目】下列有关有机物说法不正确的是( )
A. 等质量的苯乙烯和聚苯乙烯燃烧耗氧量相同
B. 四苯基乙烯(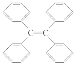 )中所有碳原子一定处于同一平面
)中所有碳原子一定处于同一平面
C. 1 mol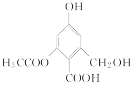 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3 mol、4 mol、1 mol
分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3 mol、4 mol、1 mol
D. 1molβ紫罗兰酮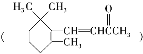 与1molBr2发生加成反应可得3种产物
与1molBr2发生加成反应可得3种产物
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某有机物是药物生产的中间体,其结构简式如图。下列有关叙述正确的是
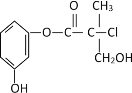
A.该有机物与溴水可发加成反应
B.该有机物与浓硫酸混合共热可发生消去反应
C.1 mol该有机物与足量NaOH溶液反应最多消耗3molNaOH
D.该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
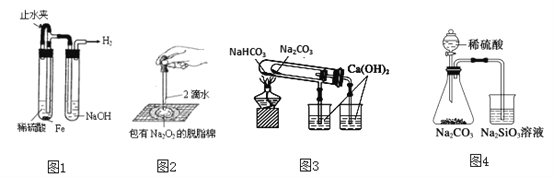
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用废铁为主要原料生产黄色颜料氧化铁黄(化学式:FeOOH)的一种工艺流程如下:
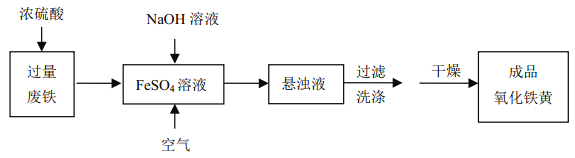
主要反应:4FeSO4+O2+8NaOH→4FeOOH↓+4Na2SO4+2H2O,完成下列填空:
(1)钢铁在潮湿的空气中发生吸氧腐蚀的正极反应式为___________________,钢铁的电化学保护有一种是外加电流阴极保护法,另一种是______________阴极保护法。
(2)废铁在反应前需清洗表面油污,请用水解平衡移动原理解释常用热的纯碱溶液清洗废铁表面油污的原因________________________________________________。
(3)FeSO4的氧化过程若温度太高会发生副反应而产生红褐色沉淀[Fe(OH)3],其离子方程式是_________________、 ___________________。
(4)检验氧化铁黄沉淀洗涤是否完全的方法是:向最后一次洗涤液中加入_______试剂,若出现_______现象则表明未洗涤完全。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ、分子中价层电子对之间的斥力主要顺序为:i、孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;iv、其他。请仔细阅读上述材料,回答下列问题:
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表:
n+m | 2 | ________ |
VSEPR理想模型 | ________ | 正四面体 |
价层电子对之间的理想键角 | ________ | 109°28′ |
(2)请用VSEPR模型解释CO2为直线型分子的原因_________________________________;
(3)H2O分子的立体构型为:___________________,请你预测水分子中∠H-O-H的大小范围并解释原因______________________________________________________________;
(4)SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S-Cl、S-F之间以单键结合。请你预测 SO2Cl2和SO2F2分子的立体构型:_____________________________, SO2Cl2分子中∠Cl-S-Cl________________(选填“<”、“>”或“=”)SO2F2分子中∠F-S-F。
(5)用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型
分子或 离子 | PbCl2 | XeF4 | SnCl62- | PF3Cl2 | HgCl42- | ClO4-- |
空间 构型 | _____ | _____ | _____ | _____ | _____ | _____ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体,下列说法正确的是 ( )
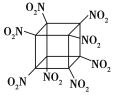
A. 分子中C、N间形成非极性键B. 1 mol该分子中含8 mol二氧化氮
C. 该物质既有氧化性又有还原性D. 该物质爆炸产物是NO2、CO2、H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化氢(![]() )、氧硫化碳(COS)均可作储粮害虫杀剂。请回答下列问题:
)、氧硫化碳(COS)均可作储粮害虫杀剂。请回答下列问题:
(1)磷原子的核外电子排布式______________,核外有______种不同能量的电子;其最外层有____种运动状态不同的电子,这些电子占据的轨道数为____个。
(2)氧硫化碳中,元素的非金属性最强的元素在周期表中的位置是______;已知COS与![]() 的结构相似,试写出COS的电子式______________,COS属于_____分子(填“极性”或“非极性”)。
的结构相似,试写出COS的电子式______________,COS属于_____分子(填“极性”或“非极性”)。
氧硫化碳水解及部分应用流程如下(部分产物已略去):
COS![]() H2S
H2S![]() Na2S
Na2S![]() M溶液+H2
M溶液+H2
(3)写出反应Ⅱ的离子方程式:_____________________;
(4)硫酸工业生产中接触室内发生的反应方程式为___________;在实际生产中,操作温度选定400~500℃、压强通常采用常压的原因分别是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关含氮化合物的性质实验。

Ⅰ.某研究性学习小组利用如图装置研究硝酸的性质。
实验一:甲同学用如图装置来证实稀硝酸与铜反应生成NO
(1)从A中向U形管中注满稀硝酸后,发生的现象是___。
(2)以下收集NO气体的各种装置中,合理的是___。(填序号,多选不给分)

(3)在100mL混合溶液中,HNO3和H2SO4的物质的量浓度分别是0.4mol/L,0.1mol/L,向该混合液中加入1.92g铜粉,加热待充分反应后,所得溶液中Cu2+的物质的量浓度是__。
实验二:乙组同学利用上述装置完成浓硝酸与铜的反应
(4)乙组同学发现实验室里有几瓶浓硝酸呈黄色,请用化学方程式和简单的文字说明解释这种现象: ___。
Ⅱ.某同学用如图实验装置(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请回答下列问题:

(5)写出制取氨气的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
1 | ||||||||||||||||||
2 | A | B | C | |||||||||||||||
3 | D | E | F | G | H | I | J | K | ||||||||||
4 | M | |||||||||||||||||
(1)在上表用字母标出的12种元素中,化学性质最不活泼的是____(用元素符号表示,下同),属于过渡元素的是___(该空格用表中的字母表示)。
(2)为比较元素A和G的非金属性强弱,用下图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_____,能说明A和G非金属性强弱的化学方程式是______。
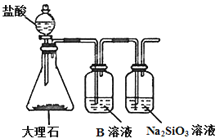
(3)J的氢化物的电子式为____,最高价氧化物对应的水化物的化学式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com