
【题目】某化合物的分子式为C5H11Cl,分析数据表明:分子中有两个—CH3、两个—CH2—、一个![]() 和一个—Cl,它的可能的结构有几种
和一个—Cl,它的可能的结构有几种
A. 2 B. 3 C. 4 D. 5
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W原子序数依次增大,X原子核外有9个电子,Y原子最外层电子数是最内层电子数的一半,Z最高正价是最低负价绝对值的3倍。下列叙述正确的是( )
A. 原子半径:W<X<Y<Z
B. 化合物Y2Z中既有离子键、又有共价键
C. Y、W最高价氧化物对应水化物的溶液均能溶解氧化铝
D. 简单气态氢化物的稳定性由强到弱的顺序:Z、W、X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求:
组 | A槽 | B槽 |
1 | NaCl | AgNO3 |
2 | AgNO3 | CuCl2 |
3 | Na2SO4 | AgNO3 |
4 | NaOH | CuSO4 |

①工作一段时间后A槽pH上升,B槽的pH下降;
②b、c两极上反应的离子的物质的量相等。
(1)应选择的电解质是上述四组中的第________组。
(2)该组电解过程中各电极上的电极反应为:a极___b极____c极___ d极____
(3)当b极上析出7.1 g电解产物时,a极上析出产物的质量为________g;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 将1molCl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA
B. 100 g CaCO3晶体和136 g KHSO4晶体中含有的离子数分别为2 NA 和3 NA
C. 3mol Fe在纯氧中完全燃烧转移的电子数为8NA
D. 已知:N2(g)+3H2(g) ![]() 2NH3 (g) ΔH=-92 kJ·mol-1,当有46 kJ热量放出时,形成NA个共价键
2NH3 (g) ΔH=-92 kJ·mol-1,当有46 kJ热量放出时,形成NA个共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境保护、社会可持续发展密切相关,下列说法或做法合理的是
A. 进口国外电子垃圾,回收其中的贵重金属
B. 将地沟油回收加工为生物柴油,提高资源的利用率
C. 洗衣粉中添加三聚磷酸钠,增强去污效果
D. 大量生产超薄塑料袋,方便人们的日常生活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁和高铁酸钾都是常见的水处理剂。某兴趣小组以铁屑为原料模拟工业上制备氯化铁及进一步氧化制备高铁酸钾的流程如下:

请回答下列问题:
(1)“氧化”阶段通入过量空气比用氯气作氧化剂具有的优点是__________________________________。
(2)“合成”阶段生成Na2FeO4的离子方程式为__________________________________。
(3)为了检验“氧化”过程中所得FeCl3溶液中是否含有Fe2+,某同学取少量溶液于试管中,选用下列试剂可以达到目的的是_______(填字母)。
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.苯酚溶液
若选用酸性K MnO4溶液进行检验,请分析方案是否合理,并说明理由:_____________________________。
(4)过程①制取FeCl3固体的具体操作步骤是_____________________________________________________。若使6.4mol/LFeCl3饱和溶液不析出Fe(OH)3,需控制溶液的pH小于_______{已知该实验条件下,Ksp[(Fe(OH)3]=8.5×10-36,Kw=1.1×10-13,1.13≈1.33}
(5)在不同温度和不同pH下,FeO42-的稳定性如下图所示:

从上图分析,为了提高“合成”阶段Na2FeO4的产率,可采取的实验条件范围为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的叙述中错误的是
A. 在T℃时,某溶液中c(H+)=![]() ,则该溶液一定显中性
,则该溶液一定显中性
B. 25℃时,如弱酸与强碱溶液的pH之和等于14,则它们等体积混合液呈酸性
C. 常温下,pH相等的NaOH溶液与氨水稀释后保持pH仍然相等,则氨水加水多
D. 体积和pH均相等的HCl与CH3COOH溶液分别与足量锌粒反应,放出H2一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命法写出下列物质名称或结构简式
(1) __________
__________
(2) ____________
____________
(3)![]() ___________
___________
(4)![]() ____________
____________
(5)2,6-二甲基-4-乙基辛烷_______
(6)2-甲基-1-戊烯____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图为其工作原理和废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是
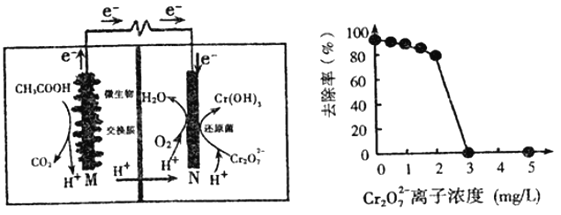
A. 反应一段时间后,N极附近的溶液pH下降
B. 外电路转移4mol电子时,M 极产生22.4LCO2
C. Cr2O72-离子浓度较大时,可能会造成还原菌失活
D. M为电池正极,CH3COOH被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com