
【题目】磷化氢(PH3)、氧硫化碳(COS)均可作储粮害虫杀剂。请回答下列问题:
(1)磷原子的核外电子排布式______,核外有___种不同能量的电子;其最外层有___种运动状态不同的电子,这些电子占据的轨道数为___个。
(2)氧硫化碳中,元素的非金属性最强的元素在周期表中的位置是______;已知COS与CO2的结构相似,试写出COS的电子式_______________,COS属于_____分子(填“极性”或“非极性”)。
(3)用硫酸铜溶液吸收PH3时的化学方程式为:
___CuSO4+ PH3+ H2O→ Cu3P↓+ H3PO4+ H2SO4
(4)配平上述方程式,并标出电子转移方向与数目。
上述反应中氧化剂是______,当吸收2.2molPH3转移电子______mol。
氧硫化碳水解及部分应用流程如下(部分产物已略去):
COS![]() H2S
H2S![]() Na2S
Na2S![]() M溶液+H2
M溶液+H2
(5)写出反应II的离子方程式:_________;
(6)若M溶液中硫元素的存在形式为S2O32﹣,则反应Ⅲ的离子方程式为_________。
【答案】 1s22s22p63s23p3 5 5 4 第二周期第VIA族 ![]() 极性
极性 ![]() CuSO4 4.8 H2S+ 2OH- →S2- + 2H2O 2S2﹣+5H2O
CuSO4 4.8 H2S+ 2OH- →S2- + 2H2O 2S2﹣+5H2O![]() S2O32﹣+4H2↑+2OH﹣
S2O32﹣+4H2↑+2OH﹣
【解析】(1)磷的质子数为15,原子的核外电子排布式1s22s22p63s23p3,核外有5种不同能量的电子;各电子的运动状态不同,其最外层有5 个电子,所以5种运动状态不同的电子,这些电子占据的轨道数为1+3=4个,故答案为:1s22s22p63s23p3;5;5;4;
(2)氧硫化碳中,元素的非金属性最强的元素是氧元素,在周期表中的位置为第二周期第ⅥA族;碳原子与氧氧原子、硫原子形成2对共用电子对,COS分子电子式为![]() ,COS分子中正负电荷中心不重合,所以是极性分子,故答案为:第二周期第ⅥA族;
,COS分子中正负电荷中心不重合,所以是极性分子,故答案为:第二周期第ⅥA族;![]() ;极性;
;极性;
(3)1)该方程式中Cu价态由+2→+1,P价态由-3→+5,为保证化合价升降数相等,Cu3P与H3PO4计量数分别为8、3,CuSO4的系数是24,H2SO4系数是24,根据元素守恒,得到:24CuSO4+11PH3+12H2O═8Cu3P↓+3H3PO4+24H2SO4,电子转移数目为: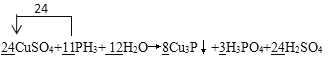 ,故答案为:
,故答案为: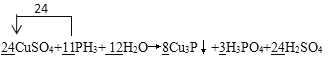 ;
;
2)该方程式中Cu价态由+2→+1,所以氧化剂是硫酸铜;11molPH3转移电子为24mol,则2.2molPH3转移电子为4.8mol,故答案为:硫酸铜;4.8;
(4)II是硫化氢与氧氧化钠反应生成硫化钠,硫化氢是弱电解质,反应的离子方程式为:H2S+2OH-=S2-+2H2O,故答案为:H2S+2OH-=S2-+2H2O;
(5)依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,根据硫原子守恒,产物需有因离子,根据原子守恒,产物还有氢氧根离子,反应为:2S2-+5H2O![]() S2O32-+4H2↑+2OH-,故答案为:2S2-+5H2O
S2O32-+4H2↑+2OH-,故答案为:2S2-+5H2O![]() S2O32-+4H2↑+2OH-。
S2O32-+4H2↑+2OH-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,反应A2 + B2 ![]() 2AB △H= Q kJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线。下列有关说法正确的是
2AB △H= Q kJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线。下列有关说法正确的是

A. Q >0
B. A2、B2中最少有一种是气态物质
C. b对应的平衡状态时化学反应速率比c对应的平衡状态时化学反应速率大
D. AB一定是气体物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下式表示一种有机物的结构,关于它的性质的叙述中不正确的是

A. 它有酸性,能与Na2CO3溶液反应
B. 它可以水解,水解产物只有一种
C. 1mol该有机物最多能和8mol NaOH反应
D. 1mol该有机物最多能和8mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
(1) H2 和CO合成甲醇反应为:CO(g)+2H2(g)![]() CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为_______;10min内用H2表示的化学反应速率为_______;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有_______(填一种合理的措施)。
CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为_______;10min内用H2表示的化学反应速率为_______;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有_______(填一种合理的措施)。

(2) 二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g) +3H2(g) ![]() CH3OH(g) +H2O(g)+Q。
CH3OH(g) +H2O(g)+Q。
①该反应的平衡常数表达式为K=________。②在恒容密闭容器中使CO2和H2(物质的量之比为1∶3)发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如下图所示,则Q_________0(填“大于”或“小于”)
(3) 如下图所示,利用缺铁氧化物[如Fe0.9O]可实现CO2的综合利用。请说明该转化的2个优点_____________。若用1 mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成________mol C(碳)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,当一个有机物分子中存在两个碳碳双键时,累积双键(如C=C=C)是不稳定的。现有烯烃A(其相对分子质量为84)在一定条件下可以按下面的框图进行反应,B的一卤代物有二种结构。

(F1与F2;G1与G2互为同分异构体)
请填空:
(1)A的结构简式是______________;G1的结构简式是______________
(2)框图中属于取代反应的是________;属于消去反应的是______(填数字代号)。
(3)D在碱性条件下完全水解产物的结构简式是______________________;其(水解产物)含两个碳原子的同系物在浓硫酸、1400C的条件下生成六元环的化学方程式为 ________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境污染已经成为人类社会面临的重大威胁,下列对应关系不正确的是( )
环境问题 | 造成环境问题的主要物质 | |
A | 酸雨 | 二氧化硫、氮氧化物 |
B | 臭氧空洞 | 二氧化碳 |
C | 白色污染 | 塑料垃圾 |
D | 光化学烟雾 | 氮氧化物、碳氢化合物 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用吸附了氢气的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是 ( )
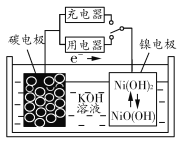
A.放电时,负极的电极反应式为H2-2e-+2OH-=2H2O
B.充电时,阳极的电极反应式为Ni(OH)2+OH--e-=NiO(OH)+H2O
C.放电时,OH-移向镍电极
D.充电时,将电池的碳电极与外电源的正极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com