
【题目】下列能级中轨道数为5的是( )
A. s能级B. p能级C. d能级D. f能级
科目:高中化学 来源: 题型:
【题目】磷化氢(PH3)、氧硫化碳(COS)均可作储粮害虫杀剂。请回答下列问题:
(1)磷原子的核外电子排布式______,核外有___种不同能量的电子;其最外层有___种运动状态不同的电子,这些电子占据的轨道数为___个。
(2)氧硫化碳中,元素的非金属性最强的元素在周期表中的位置是______;已知COS与CO2的结构相似,试写出COS的电子式_______________,COS属于_____分子(填“极性”或“非极性”)。
(3)用硫酸铜溶液吸收PH3时的化学方程式为:
___CuSO4+ PH3+ H2O→ Cu3P↓+ H3PO4+ H2SO4
(4)配平上述方程式,并标出电子转移方向与数目。
上述反应中氧化剂是______,当吸收2.2molPH3转移电子______mol。
氧硫化碳水解及部分应用流程如下(部分产物已略去):
COS![]() H2S
H2S![]() Na2S
Na2S![]() M溶液+H2
M溶液+H2
(5)写出反应II的离子方程式:_________;
(6)若M溶液中硫元素的存在形式为S2O32﹣,则反应Ⅲ的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 常温下,在pH=3的CH3COOH溶液和pH=3的H2SO4溶液中,水的电离程度前者小于后者
B. 0.1 molL﹣1 CH3COONa溶液与0.05 molL﹣1盐酸等体积混合后的酸性溶液中:c(Cl﹣)>c(CH3COO﹣)>c(CH3COOH)>c(H+)
C. 某温度时水的离子积常数KW=10-13,若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合,若所得混合液pH=2,则a∶b=9 ∶2(忽略溶液混合后的体积变化)
D. 常温下,在10 mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20 mL(忽略溶液混合后的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 物质发生化学反应时必然伴随着能量变化
B. 金属铜导电,故金属铜是电解质
C. 自发反应都是熵增大的反应
D. 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W为五种短周期元素。X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价代数和为4;Z的单质常用于漂白工业;R是短周期元素中金属性最强的元素,W是生活中的常见金属,其氧化物常做耐高温材料。回答下列问题:
(1)Y元素的名称______,在周期表中的位于第三周期__________族
(2)W与Z单质化合得到的物质属于__________化合物(选填“离子”或“共价”),向其溶液中加入足量NaOH溶液,反应的离子方程式为______。
(3)工业上常用W单质与氨气在1700℃发生置换反应,生成一种最轻的气体和一种坚硬耐磨的固体,试写出该反应的化学方程式_________________________。
(4)化合物甲由元素X、R组成,甲能与水剧烈反应,并产生大量气泡,写出其化学反应方程式______,甲的电子式为_____________。
(5)为比较元素X和Y的非金属性强弱,下列方法不可行的是___。
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以食盐、氨气、二氧化碳等物质为原料制取纯碱。
(1)实验室提纯粗盐的一个重要环节是除去粗盐水中的杂质阳离子。某粗盐样品(主要含Ca2+、Mg2+),提纯该粗盐时,可考虑在粗盐水中加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A____________________、B____________________。
(2)上述实验操作依次为:取样、__________、沉淀、__________、加入盐酸调pH、__________、冷却结晶。
(3)以上“加入盐酸调pH”目的是____________________。
(4)写成工业上以食盐、氨气、二氧化碳等物质为原料制取纯碱反应的化学方程式:
____________________,____________________
(5)氨气与二氧化碳通入的先后顺序是:__________________,因为:____________________。该过程没有析出碳酸钠晶体,其原因是____________________。
(6)标准状况下,吸收11.2升二氧化碳气体,理论上至少需要1mol/L的氨水体积为__________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期元素A、B、C、D。A元素M层上有2对成对电子,D与A在周期表中同一主族。由A、B与D组成的化合物的浓溶液是常见的干燥剂,常温下C单质为双原子分子,其氢化物水溶液呈碱性,是一种重要的肥料。
(1)A的原子最外层共有__________种不同运动状态的电子,该层电子亚层有__________种。描述集气瓶中足量的A的氢化物与其低价态氧化物混合后,充分反应的实验现象:_____________________。
(2)元素A、B与D组成的化合物的浓溶液是常见干燥剂,其化学式是__________。写出该化合物在实验室制备乙酸乙酯时所起的作用:________________。
(3)B与C元素形成带一个单位正电荷的离子,写成该微粒的电子式____________________。写出实验室检验溶液中该离子的简单实验方案:_______________。
(4)元素A与元素D相比,非金属性较强的是__________(用元素符号表示),下列表述中能表明这一事实的是______
①比较最高价氧化物对应水化物的酸性
②比较对应气态氢化物的稳定性
③一定条件下D能从A的氢化物水溶液中置换出A单质
④A单质的熔沸点明显高于D单质
(5)C的氢化物固态时属于__________晶体,该氢化物与A的最高价氧化物水化物反应的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组可用同种方法除去杂质(括号内物质)的是
A. 植物油(水) 与 乙醇(水)
B. 蛋白质溶液(NaCl)与淀粉溶液(KI)
C. 泥水(淀粉溶液)与 Fe(OH)3胶体(FeCl3)
D. 氧化钙(碳酸钙) 与 NaHCO3(Na2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
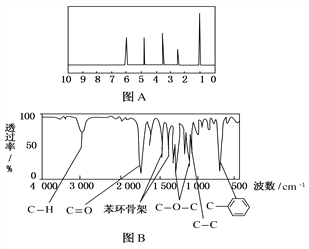
【题目】某有机化合物A经李比希法测得其中含碳为72.0%、含氢为6.67%,其余为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为150。
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3,如图A所示。
方法三:利用红外光谱仪测得A分子的红外光谱如图B所示。请填空:
(1)A的分子式为________。
(2)A的分子中含一个甲基的依据是________(填选项字母)。
a.A的相对分子质量 b.A的分子式
c.A的核磁共振氢谱图 d.A分子的红外光谱图
(3)写出符合题意的A的一种结构简式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com