
【题目】药物瑞德西韦对新型冠状病毒(COVID-19)有明显抑制作用。K是合成瑞德西韦的关键中间体,其合成路线如下:
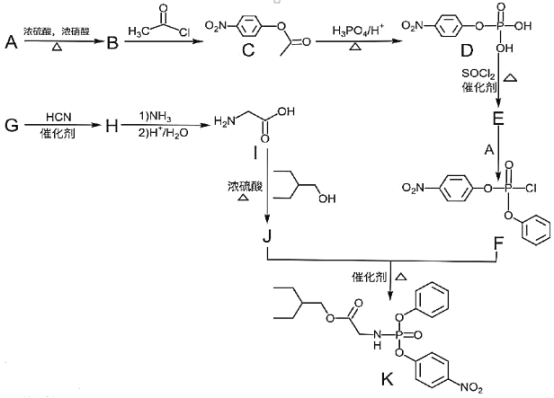
①R-OH![]() R-Cl;
R-Cl;
②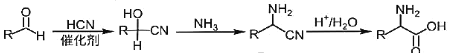
回答下列问题:
(1)B的结构简式为_________________________,B→C的反应类型为_____________,J中含氧官能团的名称为_______________,G→H的反应化学方程式为_____________________________________________。
(2)写出符合下列条件的C的同分异构体X__________________________(填结构简式,不考虑立体异构)。
①苯环上含有硝基且苯环上只有一种氢原子; ②与FeCl3溶液发生显色反应; ③1molX与足量金属Na反应可生成2g H2 。
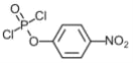
(3)E中含两个Cl原子,则E的结构简式为________________________________________________。
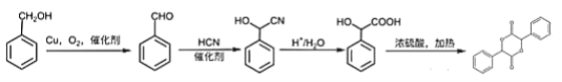
(4)写出以苯甲醇为原料制备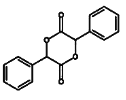 的合成路线(其它试剂任选):________________。
的合成路线(其它试剂任选):________________。
【答案】![]() 取代反应 酯基 HCHO+HCN
取代反应 酯基 HCHO+HCN![]()
【解析】
根据B到C的反应物以及C的结构简式可知B到C发生了取代反应,B为![]() ,则A到B为苯酚的硝化反应,所以A为
,则A到B为苯酚的硝化反应,所以A为![]() ,D发生信息1的反应生成E,且E中含两个Cl原子,则E为
,D发生信息1的反应生成E,且E中含两个Cl原子,则E为 ,E和A发生取代反应生成F;G到H在到I为信息2的反应,根据I结构简式知H为HOCH2CN,G为HCHO,I发生酯化反应生成J,F和J发生取代反应生成K,J为
,E和A发生取代反应生成F;G到H在到I为信息2的反应,根据I结构简式知H为HOCH2CN,G为HCHO,I发生酯化反应生成J,F和J发生取代反应生成K,J为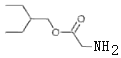 ,结合题目分析解答。
,结合题目分析解答。
(1)根据分析可知B为![]() ;B到C为酚羟基上的氢原子被取代的过程,所以反应类型为取代反应;J为
;B到C为酚羟基上的氢原子被取代的过程,所以反应类型为取代反应;J为 ,含氧官能团为酯基;G到H发生信息2的反应,方程式为:HCHO+HCN
,含氧官能团为酯基;G到H发生信息2的反应,方程式为:HCHO+HCN![]() ;
;
(2)C的同分异构体X满足:
①苯环上含有硝基且苯环上只有一种氢原子,说明结构对称,且至少含有一对相同的取代基;
②与FeCl3溶液发生显色反应说明含有酚羟基;
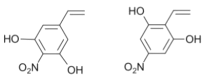
③1molX与足量金属Na反应可生成2g H2说明除酚羟基外还含有一个羟基,综合分析可知X可能为 ;
;
(3)根据分析可知E为 ;
;
(4)苯甲醇为![]() ,目标物中有酯基形成的一个六元环,六元环上含有4个碳,则首先需要将苯甲醇支链上的碳链加长,羟基可以催化氧化生成醛基,根据信息2可知醛基和HCN在催化剂作用下可加长碳链,同时生成羟基,再将—CN转化成羧基,再进行酯化反应即可得到目标物,所以合成路线为
,目标物中有酯基形成的一个六元环,六元环上含有4个碳,则首先需要将苯甲醇支链上的碳链加长,羟基可以催化氧化生成醛基,根据信息2可知醛基和HCN在催化剂作用下可加长碳链,同时生成羟基,再将—CN转化成羧基,再进行酯化反应即可得到目标物,所以合成路线为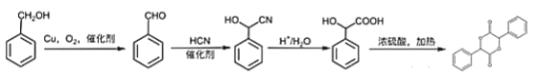 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在1L恒容密闭容器中,发生反应2NO(g)+O2(g)![]() 2NO2(g)。
2NO2(g)。
(1)某温度时,按物质的量比2:1充入NO和O2开始反应,n(NO)随时间变化如表:
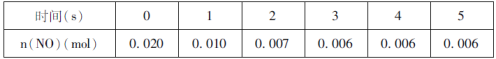
以O2浓度变化表示的反应速率,0~4s内的________(填“小于”、“大于”或“等于”)1~5s内的。
(2)该反应的平衡常数表达式为K=________,能说明该反应已达到平衡状态的是________。
A.气体颜色保持不变 B.气体平均相对分子质量保持不变
C.v逆(NO)=2v正(O2) D.气体密度保持不变
(3)已知:K(300℃)>K(400℃)。下列措施能使该反应的反应速率增大且平衡向正反应方向移动的是________。
A.升高温度 B.充入Ar使压强增大 C.充入O2使压强增大 D.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx的排放主要来自于汽车尾气,包含 NO2 和 NO I.
(1)用 CH4 催化还原 NOx 可以消除氮氧化物的污染。例如:
a.CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) H1= -574kJ/mol
b.CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) H2= -1160kJ/mol
①这两个反应在热力学上趋势均很大,其原因是:______________。
②有利于提高 NOx 的平衡转化率的反应条件是:______________(至少答一条)。
③在相同条件下,CH4(g)+2NO2(g)=N2(g)+2H2O(g)+CO2(g) H2=______________kJ/mol
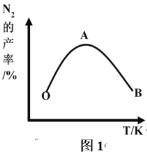
(2)为了提高 CH4 和 NO 转化为 N2 的产率,种学家寻找了一种新型的催化剂。将 CH4 和 NO 按一定比例、一定流速通过装有上述新型催化剂的反应器中,测得 N2 的产率与温度的关系如图1所示,OA 段 N2 产率增大的原因是______________。 AB 段 N2 产率降低的可能原因是______________(填标号)
A. 催化剂活性降低 B. 平衡常数变大 C. 副反应增多
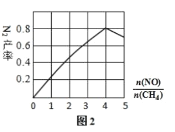
(3)N2 的产率与![]() ,由图可知
,由图可知![]() 最佳约为____________
最佳约为____________
II.有人利用反应 2C(s)+2NO2(g) ![]() N2(g)+2CO2(g) ΔH=-64.2kJ/mol 对 NO2 进行吸附。在 T℃下,向密闭容器中加入足量的 C 和一定量的 NO2 气体,图为不同压强下上述反应经过 相同时间,NO2的转化率随着压强变化的示意图。
N2(g)+2CO2(g) ΔH=-64.2kJ/mol 对 NO2 进行吸附。在 T℃下,向密闭容器中加入足量的 C 和一定量的 NO2 气体,图为不同压强下上述反应经过 相同时间,NO2的转化率随着压强变化的示意图。
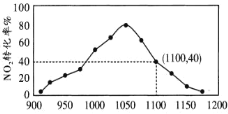
用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作 Kp);在 T℃、 1100KPa 时,该反应的化学平衡常数 Kp=______________ (计算表达式表示); 已知:气体分压(P 分)=气体总压(P 总)×体积分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
⑴4FeO·Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
⑵2Na2CrO4+H2SO4![]() Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是
A.反应⑴和⑵均为氧化还原反应
B.反应⑴的氧化剂是O2,还原剂是FeO·Cr2O3
C.高温下,O2的氧化性大于Fe2O3小于Na2CrO4
D.生成1mol的Na2Cr2O7时共转移7mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以物质的量为中心的相关计算,已知阿伏加德罗常数为NA。
(1)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是_________,在相同温度和相同压强条件下,体积最大的是___________。
(2)73.0g HCl气体中含有_______个分子、______个质子。
(3)23.75 g某+2价金属的氯化物(MCl2)中含有3.01×1023个Cl-,则MCl2的摩尔质量为______, M的相对原子质量为________。
(4)将0.5L1mol/L FeCl3溶液加水稀释至1L,所得溶液中氯离子的物质的量浓度是_____。
(5)3.01×1023个CO2在标准状况下的体积约为______L,它与_____g CO含有相同的氧原子数。
(6)在标准状况下22.4 L由氮气和氧气组成的混合气体,其质量为30g,则其中氧气的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界水产养殖协会网介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。下列说法正确的是
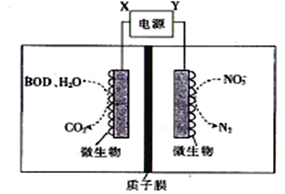
A. X为电源负极
B. 若该装置在高温下进行,则净化效率将降低
C. 若有1molNO3-被还原,则有6molH+通过质子膜迁移至阴极区
D. 若BOD为葡萄糖(C6H12O6),则1mol葡萄糖被完全氧化时,理论上电极流出20 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大豆中含有丰富的蛋白质、脂肪等营养物质,由大豆加工出来的食品很多,深受人们喜爱。请回答下列问题:
(1)我们所吃的豆腐的主要成分是________(填写字母)。
A.凝胶 B.蛋白质 C.脂肪 D.淀粉
(2)点豆腐所采用的凝聚剂是________(填写字母)。
A.石膏 B.硫酸钡 C.氢氧化钠 D.硫酸
(3)我们食用的大豆,最终补充给人体的主要成分是________(填写字母)。
A.氨基酸 B.蛋白质 C.多肽 D.糖类
(4)大豆中含有一定量的酯类。该液态酯类的水解产物是丙三醇(俗称________)和________,其分子结构中________(填“有”或“无”)碳碳双键,丙三醇的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,此时硫酸铅电极处生成Pb。下列有关说法正确的是
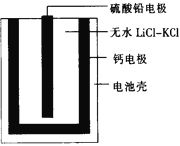
A. 输出电能时,外电路中的电子由硫酸铅电极流向钙电极
B. 放电时电解质LiCl-KCl中的Li+向钙电极区迁移
C. 电池总反应为Ca+PbSO4+2LiCl![]() Pb+Li2SO4+CaCl2
Pb+Li2SO4+CaCl2
D. 每转移0.2 mol电子,理论上消耗42.5 g LiCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池,电池反应如下: PbO2 + Pb + 2H2SO4 ![]() 2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
A. PbO2放电时是电池的负极,充电时是电池的阳极
B. 负极的电极反应式为:Pb + SO42—– 2e–=PbSO4
C. 放电时,PbO2得电子,被氧化
D. 电池放电时,溶液酸性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com