
【题目】以物质的量为中心的相关计算,已知阿伏加德罗常数为NA。
(1)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是_________,在相同温度和相同压强条件下,体积最大的是___________。
(2)73.0g HCl气体中含有_______个分子、______个质子。
(3)23.75 g某+2价金属的氯化物(MCl2)中含有3.01×1023个Cl-,则MCl2的摩尔质量为______, M的相对原子质量为________。
(4)将0.5L1mol/L FeCl3溶液加水稀释至1L,所得溶液中氯离子的物质的量浓度是_____。
(5)3.01×1023个CO2在标准状况下的体积约为______L,它与_____g CO含有相同的氧原子数。
(6)在标准状况下22.4 L由氮气和氧气组成的混合气体,其质量为30g,则其中氧气的质量为________g。
【答案】SO2 H2 2NA 36NA 95g/mol 24 1.5mol/L 11.2 28 16
【解析】
(1)质量相同的H2、NH3、SO2、O3四种气体中,N=nNA=mNA/M可知,质量相同时气体分子数与摩尔质量成反比,摩尔质量越大,含有的分子数越小,所以含有分子数最少的是摩尔质量最大的为SO2;由V=![]() ×Vm可知,质量相同时,气体体积与摩尔质量成反比,体积最大的是气体摩尔质量最小的,则体积增大的为H2;
×Vm可知,质量相同时,气体体积与摩尔质量成反比,体积最大的是气体摩尔质量最小的,则体积增大的为H2;
(2)73.0gHCl气体的物质的量为:n(HCl)=73.0g÷36.5g/mol=2mol,2molHCl中含有2NA个HCl分子,含有质子数为:2NA×18=36NA;
(3)因MCl2中含有3.01×1023个Cl,则Cl的物质的量为![]() =0.5mol,M2+的物质的量0.25mol,即MCl2的物质的量为0.25mol,MCl2的摩尔质量M=
=0.5mol,M2+的物质的量0.25mol,即MCl2的物质的量为0.25mol,MCl2的摩尔质量M=![]() =
=![]() =95g/mol;因MCl2的摩尔质量为95g/mol,所以相对分子质量为95,金属M的相对原子质量为95-35.5×2=24;
=95g/mol;因MCl2的摩尔质量为95g/mol,所以相对分子质量为95,金属M的相对原子质量为95-35.5×2=24;
(4)0.5L1mol/LFeCl3溶液中氯离子的浓度为3mol/L,根据稀释定律,稀释前后氯离子的物质的量不变,令稀释后所得溶液中氯离子的浓度为c,则0.5L×3mol/L=1L×c,解得c=1.5mol/L;
(5)3.01×1023个CO2物质的量为![]() =0.5mol,标况下体积V=0.5mol×22.4L/mol=11.2L;含有氧原子个数为:0.5×2×NA=NA个,则:
=0.5mol,标况下体积V=0.5mol×22.4L/mol=11.2L;含有氧原子个数为:0.5×2×NA=NA个,则:![]() ×1×NA=NA,解得m(CO)=28g;
×1×NA=NA,解得m(CO)=28g;
(6)标况下22.4L混合气体的物质的量n=![]() =1mol,设氮气的物质的量为xmol,氧气的物质的量为ymol,根据物质的量为1mol,质量为30g可知:x+y=1①,28x+32y=30②,解①②可得y=0.5,则氧气的质量m=nM=0.5mol×32g/mol=16g。
=1mol,设氮气的物质的量为xmol,氧气的物质的量为ymol,根据物质的量为1mol,质量为30g可知:x+y=1①,28x+32y=30②,解①②可得y=0.5,则氧气的质量m=nM=0.5mol×32g/mol=16g。


科目:高中化学 来源: 题型:
【题目】室温下,分别用0.1000molL-1的NaOH标准液滴定浓度均为0.1molL-1的三种酸HX、HY、和HZ,滴定曲线如图所示,下列说法错误的是

A.三种酸的酸性强弱:HX>HY>HZ
B.等浓度、等体积的HY溶液和NaY溶液混合,混合液显酸性
C.用NaOH标准液滴定HZ溶液时,选用酚酞作指示剂
D.滴定HX的曲线中,当中和百分数为50%时,溶液中存在c(X-)<c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol·L1盐酸滴定10.0 mL浓度为0.1 mol·L1Na2A溶液,所得滴定曲线如图所示。下列说法错误的是
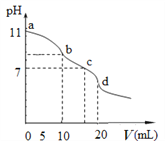
A.Ka2(H2A)的数量级为109
B.当V=5时:c(A2)+c(HA)+c(H2A)=2c(Cl)
C.NaHA溶液中:c(Na+)>c(HA)>c(A2)>c(H2A)
D.c点溶液中:c(Na+)>c(Cl)>c(H+)=c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知干冰晶胞属于面心立方最密堆积,晶胞中相邻最近的两个CO2分子间距为a pm,阿伏加德罗常数为NA,下列说法正确的是
A.晶胞中一个CO2分子的配位数是8
B.晶胞的密度表达式是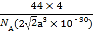 g·cm-3
g·cm-3
C.一个晶胞中平均含6个CO2分子
D.CO2分子的立体构型是直线形,中心C原子的杂化类型是sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
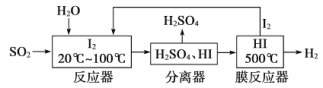
下列说法正确的是
A.分离器中的物质分离操作为过滤
B.反应器中,控制温度为20-100℃,温度过低速率慢,过高水气化且增大碘的流失,反应速率也慢
C.该工艺中I2和HI的相互转化体现了“碘循环”
D.碘循环工艺的总反应为2SO2+4H2O+I2=H2+2H2SO4+2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物瑞德西韦对新型冠状病毒(COVID-19)有明显抑制作用。K是合成瑞德西韦的关键中间体,其合成路线如下:
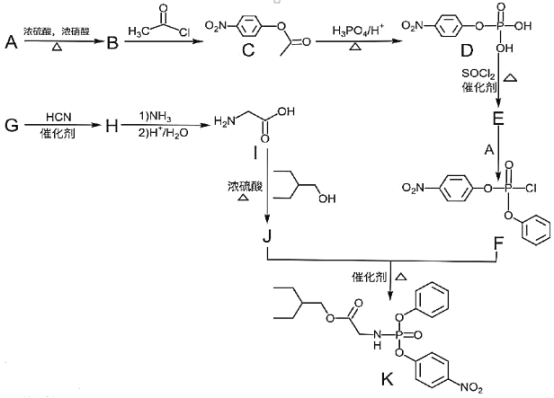
①R-OH![]() R-Cl;
R-Cl;
②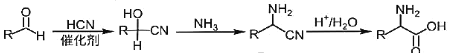
回答下列问题:
(1)B的结构简式为_________________________,B→C的反应类型为_____________,J中含氧官能团的名称为_______________,G→H的反应化学方程式为_____________________________________________。
(2)写出符合下列条件的C的同分异构体X__________________________(填结构简式,不考虑立体异构)。
①苯环上含有硝基且苯环上只有一种氢原子; ②与FeCl3溶液发生显色反应; ③1molX与足量金属Na反应可生成2g H2 。
(3)E中含两个Cl原子,则E的结构简式为________________________________________________。
(4)写出以苯甲醇为原料制备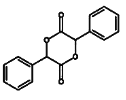 的合成路线(其它试剂任选):________________。
的合成路线(其它试剂任选):________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常用垃圾处理方法有三种:
①________法,可以产生大量肥料;
②________法,可以避免露天堆放产生的问题;
③_____法,可以使垃圾体积缩小,能彻底消灭病原体以及产生热量等优点。
(2)回收利用垃圾资源是现代生活不可忽视的重要活动。请举出生活垃圾回收利用的一个事例:_________。
(3)回收利用垃圾,首先要对垃圾进行分类,一群环保志愿者在某社区推广垃圾分类,他们在垃圾房放置了一些有分类标志的垃圾回收箱,结果却发现有许多居民并没有分类放置。造成这种现象的原因可能是________。
A.居民嫌麻烦,没有垃圾分类的习惯 B.居民每天产生的垃圾量非常多
C.居民的环保意识不强 D.居民不清楚垃圾分类的标准
(4)
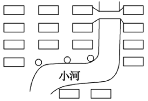
上图是某居民小区中垃圾收集点(小圆圈)的布局,它在选址上存在的两个问题是_________和________。垃圾收集点选址应考虑的因素包括(提出三点)________、________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸溶液是常用的消毒剂、漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
(查阅资料)
资料1:常温常压下,Cl2O为棕黄色气体,沸点为 3.8 ℃,42 ℃以上会分解生成 Cl2和O2, Cl2O易溶于水并与水立即反应生成 HClO。
资料2:将氯气和空气(不参与反应)按体积比 1∶3 混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O![]() Cl2O+2NaCl+2NaHCO3,用水吸收 Cl2O(不含Cl2)制得次氯酸溶液。
Cl2O+2NaCl+2NaHCO3,用水吸收 Cl2O(不含Cl2)制得次氯酸溶液。
(装置及实验)用以下装置制备次氯酸溶液

回答下列问题:
(1)各装置的连接顺序为_____→_____→_____→____→E。
(2)装置 A 中反应的离子方程式是______。
(3)装置 E中反应的化学方程式是_____。
(4)装置 B 中多孔球泡和搅拌棒的作用是_______;反应过程中,装置B需放在冷水中,其目的是_____。
(5)装置 C 的主要作用是_____。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)_____。
(7)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)在食品加工、印染、印刷、制革以及有机合成等工业中应用广泛。实验室模拟工业湿法制备焦亚硫酸钠装置如图所示。
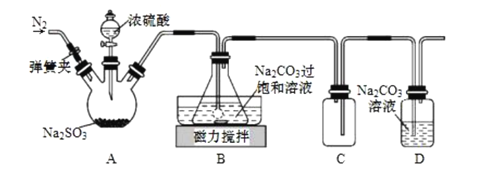
打开弹簧夹,通入一段时间N2后关闭弹簧夹,加入一定量浓硫酸;不断搅拌,控制反应温度在40℃左右,当溶液pH约为4.1时,停止反应,降温至20℃左右静置结晶。
已知:
①温度在40℃左右时,发生反应2NaHSO3=Na2S2O5+H2O。
②温度过高时焦亚硫酸钠分解:Na2S2O5=Na2SO3+SO2↑。
③焦亚硫酸钠与水易发生反应:Na2S2O5+H2O=2NaHSO3。
回答下列问题:
(1)A装置中所加硫酸通常为1:1(体积比)的浓硫酸,一般不采用90%以上的浓硫酸,原因是__。
(2)B装置中控制反应温度40℃在左右的方法是__;锥形瓶中生成NaHSO3的离子方程式为__。
(3)装置C的作用是__。
(4)锥形瓶中析出固体经减压抽滤、洗涤、晾干,可获产品。洗涤操作中依次用饱和SO2水溶液、无水乙醇洗涤,其作用是__。
(5)反应结束后,需要再次打开弹簧夹,通入一段时间N2,目的是__。
(6)某同学认为Na2S2O5属于强碱弱酸盐,在溶液中水解显碱性。实际他测得Na2S2O5溶液显酸性,请用数据帮他分析溶液显酸性的原因__。
(已知:常温下H2SO3电离常数Ka1=1.54×10-2,Ka2=1.02×10-7)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com